 SOURCE
SOURCEProblème: écart existant entre une information initiale et une information que vous souhaitez connaître.
Résolution de problèmes: ensemble d'activités planifiées nécessaires pour réduire l'écart entre les informations initiales et les informations que vous souhaitez connaître. La résolution de problèmes est un art et les bonnes habitudes acquises en pratique lors de la résolution de problèmes chimiques (et de tout aspect de la vie) vous permettent d'accéder facilement aux informations que vous souhaitez connaître.
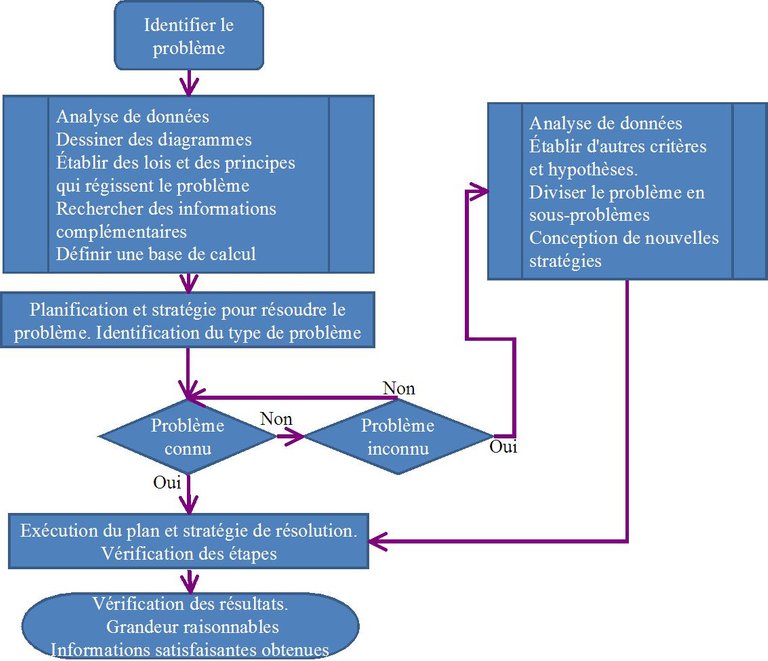
Étapes pour résoudre un problème chimique et pour tout domaine de connaissance.
1 Identification de l'information initiale, en connaître la nature
2 Recueillez des données sur le problème. Comprendre les unités chimiques et physiques et les grandeurs connexes.
3 Analysez les données, obtenez les informations nécessaires à partir de ces données. Comprendre les phénomènes liés au problème.
4 Établissez la stratégie pour combler le fossé entre les informations initiales et les informations que vous souhaitez connaître.
Dans le diagramme suivant, vous pouvez voir les étapes de base de la résolution de problèmes.
PROBLÈME
Déterminez la formule empirique et moléculaire dont l'analyse par spectromètre de masse donne la composition en pourcentage suivante d'un échantillon dont la masse moléculaire est connue pour être de 312,538 g / mol.
| Élément chimique | Ratio en Pourcentage (%) |
|---|---|
| Carbone | 76,86 |
| D'hydrogène | 12,90 |
| D'oxygène | 10,24 |
Base de calcul: 100 grammes d'échantillon (M)
Détermination de la masse de chaque élément, sur la base de la relation de pourcentage et de la base de calcul

| Élément chimique | Quantité de masse |
|---|---|
| Carbone | 76,86 g |
| D'hydrogène | 12,90 g |
| D'oxygène | 10,24 g |
| TOTAL | 100,0 g |
Détermination des masses molaires de chaque élément, par la masse atomique de chaque élément. (Stratégie)

Détermination de la formule empirique du composé chimique, divisant les moles de chaque élément entre la masse molaire du plus petit d'entre eux.
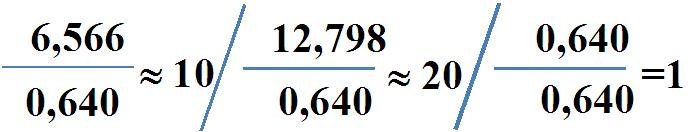
Le résultat de cette division nous donne la relation mathématique entre le nombre d'atomes dans la molécule. Dans ce cas, la relation atomique est:
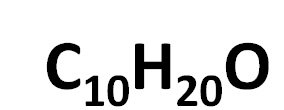
Pour 20 atomes d'hydrogène, vous avez 10 atomes de carbone et 1 oxygène.
Mais cette formule est empirique, les formules suivantes satisfont également cette relation:
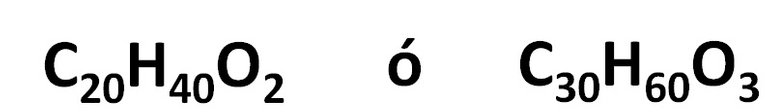
Donc pour connaître la formule moléculaire du composé organique de l'information initiale du problème.
Nous devons établir un lien entre la masse moléculaire de la formule moléculaire et la masse moléculaire de la formule empirique, afin de connaître la relation de stœchiométrie correcte.
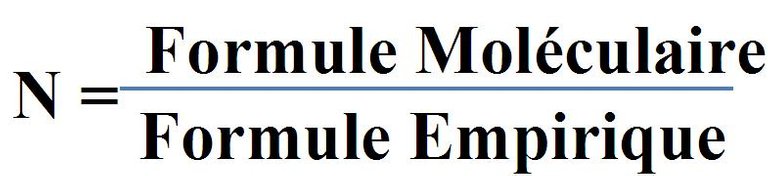
Pour déterminer la masse moléculaire de la formule empirique, établissons le tableau suivant:
| Élément chimique | N°Atomes | Masse atomique | Masse Moléculaire |
|---|---|---|---|
| Carbone | 10 | 12,011 g/mol | 120,11 g/mol |
| D'hydrogène | 20 | 1,008 g/mol | 20,16 g/mol |
| D'oxygène | 1 | 15,999 g/mol | 15,99 g/mol |
| ------- | ----- | TOTAL | 156,27 g/mol |
Ensuite, nous déterminons le facteur stœchiométrique correcte.
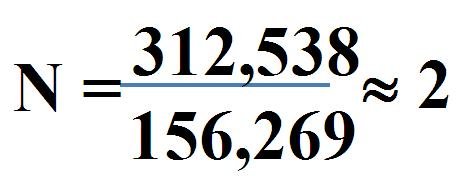
Avec cette valeur stœchiométrique, nous pouvons déterminer la formule moléculaire exacte du composé analysé. Il suffit de multiplier ce facteur par le nombre d'atomes obtenus lors du premier calcul.

Enfin, la boîte bleue est la formule empirique et la boîte rouge, la formule moléculaire. De cette façon, il est possible d'atteindre l'information désirée.
FIN
SALUTATIONS DU VENEZUELA
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @curie.
If you appreciate the work we are doing then consider voting both projects for witness by selecting stem.witness and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!