Al finalizar el estudio sobre los alcanos comenzaremos a tratar las primeras reacciones y las reglas que se rigen a estas.
Reacciones en cadena de radicales libres
En las reacciones en cadena de radicales libres hay que tener en cuenta las siguientes tres etapas:
Paso de iniciación
El cual genera como producto un intermediario reactivo. Para explicar esto usaremos como ejemplo la cloración del metano, el Cl2 al recibir luz o calor se separa en dos radicales libres, que son altamente reactivos por no cumplir la regla del octeto.
Pasos de propagación:
En los cuales el intermediario reactivo reacciona con una molécula estable para formar un producto y otro intermediario reactivo, lo que permite continuar la cadena hasta que se agota el abasto de reactivos o se destruye el intermediario reactivo. Siguiendo con el ejemplo anterior el cloro radical reacciona con una molécula de metano formando H-Cl y dejando un radical metilo el cual reacciona con una molécula de Cl2 para formar el clorometano y otro radical cloro.
Pasos de terminación
En los cuales las reacciones colaterales destruyen a los intermediarios reactivos y tienden a disminuir o a detener la reacción. Esto ocurre porque los reactivos disminuyen y los radicales libres no se forman en grandes cantidades, y los pocos que se forman reaccionan para mantenerse estables.
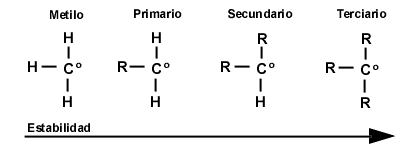
Halogenación selectiva. Estabilidad de los radicales libres
En moléculas más grandes que el metano, el reemplazo de diferentes hidrógenos puede generar distintos productos, entonces, ¿cómo saber cuál producto es el mayoritario? Para esto debemos tener en cuenta la estabilidad de los radicales libres, que cumplen el siguiente orden:
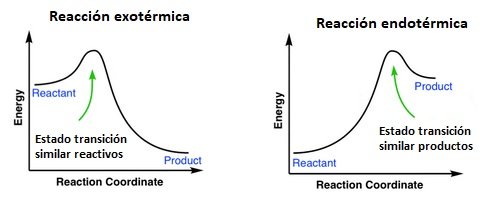
Postulado de Hammond
En una reacción endotérmica, el estado de transición se parece más a los productos en cuanto a energía y estructura. En una reacción exotérmica, el estado de transición se parece más a los reactivos en cuanto a energía y estructura. De ahí que podemos deducir la siguiente regla:
Postulado de Hammond
Las especies afines que son cercanas en energía son cercanas en estructura. La estructura de un estado de transición se parece a la estructura de la especie estable más cercana.
Inhibidores de radicales libres
Los inhibidores de radicales por lo regular se adicionan a los alimentos y a los compuestos químicos para retardar su descomposición por las reacciones en cadena de los radicales libres. Las reacciones en cadena dependen de que los pasos individuales sean rápidos, de tal forma que cada paso de iniciación genere muchas moléculas reactivas, al agregar un inhibidor este reacciona con un radical intermediario en un paso rápido, altamente exotérmico, para formar un intermediario que sea relativamente estable haciendo que el siguiente paso de la cadena se vuelva endotérmico y lento.
La vitamina C es un ejemplo de inhibidor de radicales libres, ya que por su capacidad antioxidante ralentiza la propagación de los radicales. Fuente de imagen
Intermediarios reactivos
Los radicales libres que hemos estudiado son una clase de intermediarios reactivos. Los intermediarios reactivos son especies con un tiempo de vida media corta que nunca están presentes en grandes concentraciones, ya que reaccionan tan rápidamente como se forman. En la mayoría de los casos, los intermediarios reactivos son fragmentos de moléculas (como radicales libres), y con frecuencia tienen átomos con cantidades inusuales de enlaces. Estos son:
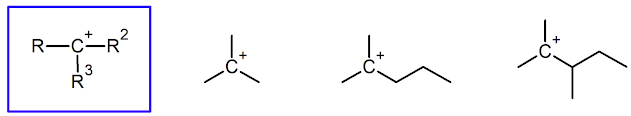
Carbocationes
Un carbocatión (también llamado ion carbonio o ion carbenio) es una especie que contiene un átomo de carbono con carga positiva. El átomo de carbono con carga positiva se une a otros tres átomos y no tiene electrones no enlazados, por lo que sólo tiene seis electrones en su capa de valencia. Tiene una hibridación sp2 su estructura es plana y tiene ángulos de enlace de aproximadamente 120°.
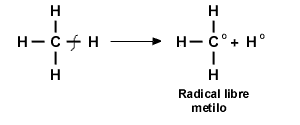
Radicales libres
Al igual que los carbocationes, los radicales libres tienen una hibridación sp1 y son planos (o casi planos). Sin embargo, a diferencia de los carbocationes, el orbital p perpendicular al plano de los enlaces C —H del radical no está vacío; contiene el electrón impar.
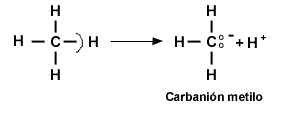
Carbaniones
Un carbanión tiene un átomo de carbono trivalente que tiene una carga negativa. Hay ocho electrones alrededor del átomo de carbono (tres enlaces y un par de electrones no enlazados), por lo que no es deficiente en electrones; por el contrario, es rico en electrones y un nucleófilo fuerte (base de Lewis).
Carbeno
Los carbenos son intermediarios reactivos sin carga que contienen un átomo de carbono divalente. El carbeno más simple tiene la fórmula .CH2 y se llama metileno, de la misma forma en que el grupo —CH2— de una molécula es llamado grupo metileno.
Espero les haya gustado y que dejen su apoyo para más contenido de química
- Basado en el Wade Leroy G. Química Orgánica.
You have a problem with your images, I can't see them.
I'll see how to fix it, thanks for letting me know.
It is ok, now.