~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
05-03-2025 - Chemistry Basics - Covalent Bond [EN]-[IT]
With this post I would like to give a brief instruction on the topic mentioned in the subject
(code notes: X_88)
Covalent Bond
remember that
The hydrogen atom is the simplest. It is made up of:
1 proton (located in the nucleus and has a positive charge)
1 electron (orbits the nucleus and has a negative charge)
Let's try to think of two hydrogen atoms that are far from each other, but that slowly in some way begin to get closer. The electron of one of the two begins to feel the electrostatic attraction towards the nucleus of the other atom and vice versa.
The energy of the system is noted that it decreases as the two atoms get closer. This energy reaches a minimum point at a certain distance, if we try to bring the hydrogen atoms even closer the energy would begin to increase. The minimum energy is reached when the interatomic distance (r0) identifies the distance needed to ensure that the system is in a stable equilibrium condition. Basically, the two hydrogen atoms are better together than alone, but this distance is a very precise distance, because if both atoms were to get closer, therefore reduce the distance between them, we would no longer be in a stable equilibrium condition.
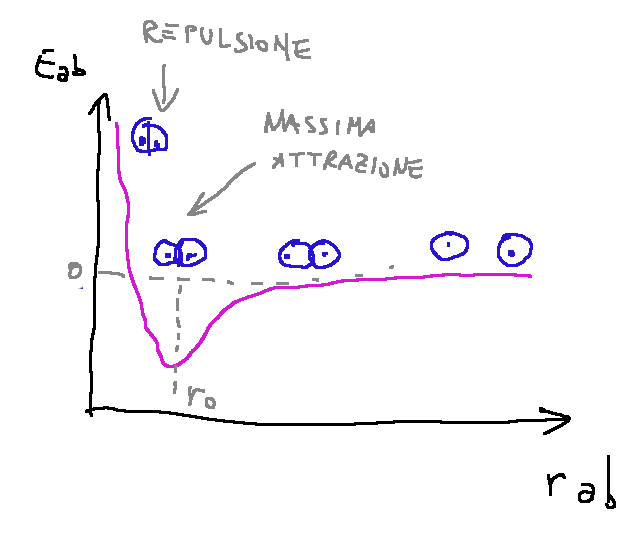
In this graph, we have the atomic radius on the abscissa, while the potential energy on the ordinate. We note that the condition of minimum potential energy occurs when the two atoms are close. We also note that when they are too close together the potential energy increases dramatically as repulsion forces come into play.
Fundamentals of Valence Bond Theory
Valence bond theory is a fundamental model that helps us understand the formation and strength of covalent bonds, the geometry of molecules, and resonance phenomena.
The fundamentals of covalent bond theory are as follows:
-Description of covalent bonding
-Atomic orbitals and hybridization
-Overlapping orbitals
-Overlapping orbitals
Hybridization of orbitals
Hybridization of orbitals is a concept that is part of valence bond theory. Hybridization describes the combination of atomic orbitals to form new hybrid orbitals, which have different shapes, energies, and orientations than the original orbitals.
Hybridization is the concept that explains the geometry and shape of molecules. It allows to explain how atoms bond together and how orbitals arrange themselves in space to minimize the repulsion between electron pairs.
Examples
Using VSEPR theory, let's try to draw the Lewis structural formulas of the following molecules:
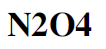
This is the molecule of Dinitrogen tetroxide.
If we think about the simplified Lewis structure we have that N₂O₄ can be seen as the union of two NO₂ groups through an N–N bond:
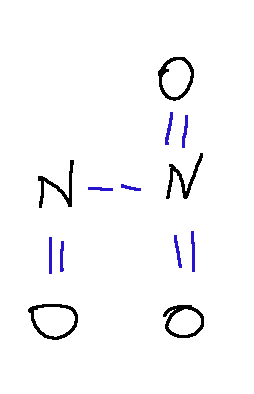
There are more complex resonance structures but in this case we can say that:
-Each N is bonded to two O, one with a double bond and one with a single bond, in resonance.
-The two N are bonded to each other
-Overall the molecule is quite symmetric.
Shape and polarity
From the point of view of the final symmetry, N₂O₄ is symmetric
The partial dipoles on the NO₂ groups tend to cancel each other.
We can say that N₂O₄ is nonpolar
Conclusions
In conclusion we can say that the covalent bond is formed when two atoms share one or more pairs of electrons in order to reach a more stable electronic configuration.
Question
The covalent bond is a key concept in the world of chemistry that explains how atoms bond together, do you remember studying it at school?

[ITALIAN]
05-03-2025 - Basi di chimica - Legame covalente [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_88)
Legame covalente
ricordiamo che
L'atomo di idrogeno è il più semplice. Esso è formato da:
1 protone (situato nel nucleo ed ha carica positiva)
1 elettrone (orbita attorno al nucleo ed ha carica negativa)
Proviamo a pensare a due atomi di idrogeno che sono lontani tra di loro, ma che piano piano in qualche maniera iniziano ad avvicinarsi. L'elettrone di uno dei due comincia a risentire dell'attrazione elettrostatica verso il nucleo dell'altro atomo e viceversa.
L'energia potenzia del sistema si nota che essa diminuisce con l'avvicinamento dei due atomi. Questa energia raggiunge un punto minimo ad una determinata distanza, se proviamo ad avvicinare ancora di più gli atomi di idrogeno l'energia inizierebbe a salire. L'energia minima viene raggiunta quando la distanza interatomica (r0) identifica la distanza utile per fare in modo che il sistema si trovi in una condizione di equilibrio stabile. Praticamente i due atomi di idrogeno stanno meglio insieme che da soli, ma questa distanza è una distanza ben precisa, perché se entrambi gli atomi si dovessero avvicinare ulteriormente, quindi ridurre la distanza tra loro, non ci troveremmo più in una condizione di equilibrio stabile.

In questo grafico abbiamo sulle ascisse il raggio atomico, mentre sulle ordinate l'energia potenziale. Notiamo che la condizione di minima energia potenziale avviene quando i due atomi sono vicini. Notiamo anche che quando sono troppo vicini l'energia potenziale aumenta drasticamente in quando entrano in gioco le forze di repulsione.
Fondamenti della Teoria del Legame di Valenza
La teoria del legame di valenza è un modello fondamentale che aiuta a comprendere la formazione e la forza dei legami covalenti, la geometria delle molecole e i fenomeni di risonanza.
I fondamenti della teoria del legame covalente sono i seguenti:
-Descrizione del legame covalente
-Orbitali atomici e ibridazione
-Sovrapposizione degli orbitali
-Sovrapposizione degli orbitali
ibridizzazione degli orbitali
L'ibridizzazione degli orbitali è un concetto che fa parte della teoria del legame di valenza. L'ibridizzazione descrive la combinazione di orbitali atomici per formare nuovi orbitali ibridi, i quali hanno diverse forme, energie e orientamenti rispetto agli orbitali originali.
L'ibridizzazione è quel concetto che spiega la geometria e la forma delle molecole. Essa permette di spiegare come gli atomi si legano tra loro e come gli orbitali si dispongono nello spazio per minimizzare la repulsione tra le coppie di elettroni.
Esempi
Usando la teoria VSEPR, proviamo a disegnare le formule di struttura di Lewis della seguente molecole:
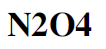
Questa è la molecola di Dinitrogeno tetrossido.
Se ragioniamo sulla struttura di Lewis semplificata abbiamo che N₂O₄ può essere visto come l’unione di due gruppi NO₂ tramite un legame N–N:

Ci sono strutture di risonanza più complesse ma in questo caso possiamo dire che:
-Ogni N è legato a due O, uno con legame doppio e uno con legame singolo, in risonanza.
-I due N sono legati l'uno all'altro
-Complessivamente la molecola è piuttosto simmetrica.
Forma e polarità
Dal punto di vista della simmetria finale, N₂O₄ risulta simmetrico
I dipoli parziali sui gruppi NO₂ tendono a cancellarsi vicendevolmente.
Possiamo dire che N₂O₄ è apolare
Conclusioni
In conclusione possiamo dire che il legame covalente si forma quando due atomi condividono una o più coppie di elettroni con il fine di raggiungere una configurazione elettronica più stabile.
Domanda
Il legame covalente è un concetto chiave nel mondo della chimica che spiega come gli atomi si legano tra loro, vi ricordate di averlo studiato a scuola?
THE END
Grazie per questa chiara e dettagliata spiegazione sul legame covalente! Mi hai riportato indietro ai tempi della scuola con quei diagrammi e le strutture di Lewis. 🧪📚 Che domanda finale: sì, il legame covalente lo ricordo bene, ma ora è tutto molto più chiaro! Grazie per il refresh! 😊
Grazie per il tuo commento. Ogni tanto ritiro fuori i vecchi appunti e cerco di ricordare i concetti principali. Appena avevo finito di scrivere questo post mi è subito venuto in mente come poter arricchire ancora meglio la spiegazione del legame covalente, magari ripercorreró il concetto più avanti fornendo quanlche dettaglio in più nella spiegazione
Learning chemistry is interesting
#hive #chemistry
Thanks for stopping by. Of all the science subjects I've studied, chemistry is one of the ones I liked the most.
Sounds like a great refresher on covalent bonds! 🔬
Really like the way you explained the energy changes when atoms get closer.
Brings back memories of chemistry class! 😃✨
Thanks for stopping by. That's right, the closer the atoms get (so the atomic radius decreases) the more the potential energy decreases. But be careful, when they are too close the atoms regain potential energy. They behave just like a couple. They are good together but be careful not to stick too close together
I remember been thought this particular topic for many months and I didn't understand. But now I understand better
If we want to summarize as much as possible we can say that the covalent bond is a type of chemical bond (there are many) in which two atoms share one or more pairs of electrons. This sharing occurs to reach a stable electronic configuration.
Argh
I’m giving up here😅
This is tough
I remember that organic compounds are predominantly made of covalent bonds