
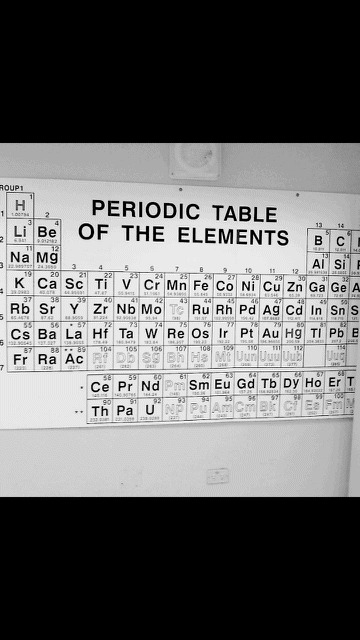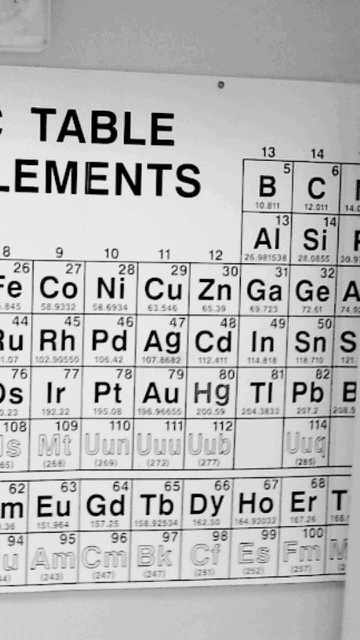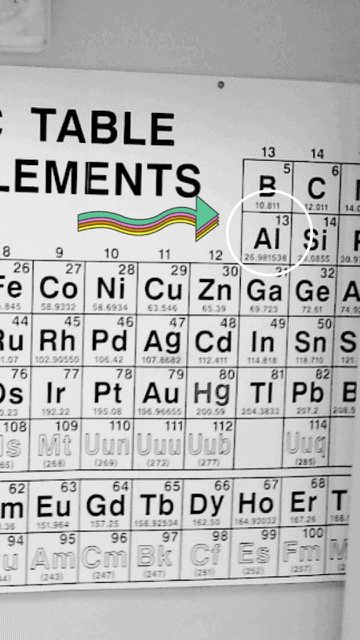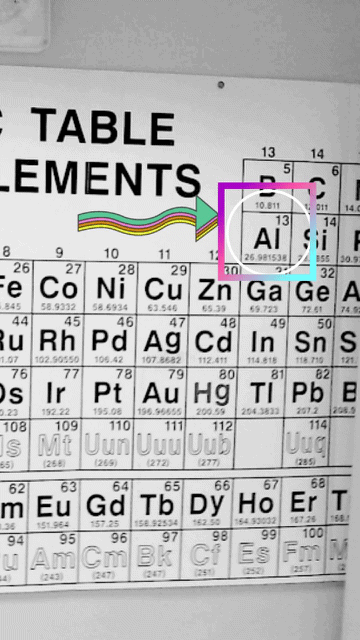
El aluminio es uno de los elementos más abundantes de la corteza terrestre, es el elemento N°13 de nuestro sistema periódico, y suele encontrarse en la naturaleza frecuentemente en forma de silicatos.
Aluminio en el sistema periódico químico
La presencia del aluminio en el agua que va a las redes de distribución para consumo humano, se debe frecuentemente al tratamiento a la cual se somete. En la mayoría de los procesos de potabilización la turbidez del agua es tratada por medio de la floculación con sulfato de aluminio, reactivo el cual permite la formación de flóculos con la turbidez, los flóculos son separados del agua por métodos físicos, sin embargo en presencia de fluoruro el aluminio adicionado puede reaccionar con este, generando la formación de fluoruro de aluminio el cual es altamente soluble, favoreciendo el aumento de las concentraciones de aluminio posterior al tratamiento del agua.
Tratamiento de floculación del agua

Fuente: El autor
Algunos estudios científicos experimentales han planteado que el aluminio presente en el agua de consumo puede ser absorbido por el organismo humano y provocar daños intestinales y/o neurológicos. Por lo antes expuesto las organizaciones competentes deben velar que el agua destinada al consumo humano cumpla con las especificaciones recomendadas según la legislación pertinente para cada nación o región.
Según la legislación pertinente en mi país "Venezuela": Gacetas oficiales: 5.021 y 36.395; “Clasificación y Control de la Calidad de los Cuerpos de Agua y Vertidos o Efluentes Líquidos”, y “Normas Sanitarias de Calidad de Agua Potable” , El aluminio en agua para uso domestico posee un máximo permisible de 0,2 mg/L.
valores máximos permisible del parámetro aluminio en agua según legislación en materia de agua

Fuente: El autor
Para determinar que un cuerpo de agua de origen natural o potable cumple con los valores de concentración de aluminio establecidos según legislación, es necesario evaluarla con un método oportuno que permita cuantificarlo, método cuya frecuencia y rango de aplicación vayan de la mano con factores tales como: el origen del agua, sus posibles usos y principalmente a la magnitud de la población involucrada en el consumo.
El MÉTODO DE ERICROMO CIANINA R. 3500-Al D, fundamenta sus principios de ejecución en uno de los método normalizados internacionales más importantes en materia de agua: "STANDARS METHODS FOR THE EXAMINATION OF WATER AND WASTEWATER. APHA- AWHA- WEF 21 st Edición, Año 2005".
Fundamento de aplicación del método
Al igual que como explique en uno de mis aportes anteriores específicamente: "DETERMINACIÓN DE HIERRO TOTAL EN AGUA NATURAL Y POTABLE POR MÉTODOS COLORIMÉTRICOS" , los principios de un método espectrofotométrico y colorimétrico se enmarcan en la siguiente cita extraída del aporte mencionado:
El método se basa en técnicas espectrofotométricas, estas son aquellas que estudian los fenómenos de absorción y transmisión de luz por diversas especies absorbentes en un sistema químico en estudio, las cuales fundamentan su aplicación en la ley de Beer-Lambert que propone que la absorbancia (absorción de luz) y la transmitancia (transmisión de luz) de un sistema químico están íntimamente ligadas y a su vez vinculadas a factores como la longitud de onda, la trayectoria de la luz y las propiedades absorbentes de cada especia involucradas.
A una longitud de onda de 535 nanométros y un pH aproximado de 6.00, el aluminio en solución forma un complejo de color rojo o rosado con la presencia de tinción de ericromo cianina. Las interferencias por hierro y manganeso se eliminan agregando solución de ácido ascórbico, La alcalinidad se regula neutralizando con ácido sulfúrico y para compensar la turbidez se prepara un blanco con EDTA. Para el éxito de la reacción tienen que controlarse el tiempo de reacción y la temperatura.
Interferencias y consideraciones
⦁ La acidez como CaCO3 en concentraciones mayores de 300 mg/L interfiere.
⦁ Los polifosfatos.
⦁ Fluoruros. La presencia de fluoruros se corrige una vez medida la concentración de fluoruro por el método respectivo, con la grafica del juego de curvas de corrección de aluminio en presencia de fluoruro 3500 Al:1.
⦁ La cristalería a usar debe lavarse con jabón libre de fosfato, posteriormente debe tratarse con ácido sulfúrico y por último curarse con agua destilada libre de aluminio.
⦁ envase y conserve las muestras en envases plásticos.
Materiales y equipos
⦁ Espectrofotómetro DR 5000.
⦁ Celdas espectrofotométricas de vidrio de 2,5 cm de ancho.
⦁ Pizeta con agua destilada libre de aluminio.
⦁ Pipetas volumétricas.
⦁ Balones aforados de 50 y 100 ml.
Reactivos y preparación de soluciones
⦁ Solución patrón estándar de concentración 5 mg/L de aluminio.
⦁ Ácido sulfúrico H2SO4 , 0.02 y 6.00 N ( N = Normalidad - Unidad química de concentración = N° de equivalentes / litros de solución).
⦁ Indicador mixto de naranja de metilo.
⦁ EDTA (ácido etilendiaminotetracético disodico dihidratado/ C10H14N2Na2O8.2H2O) 0.01 N.
⦁ Solución de ácido ascórbico: disuélva 0.1 g de ácido ascórbico C6H8O6 en 20 ml de agua destilada libre de aluminio y diluya hasta un volumen de 100 ml de volumen final.
⦁ Reactivo tampón: disuélva 136 g de acetato de sodio CH3COONa en agua destilada libre de aluminio, añada 40 ml de ácido acético CH3COOH 1 N y diluya hasta 1 litro.
⦁ Solución de tinción de reserva: Disuelva 100 mg de Eriocromo cianina R en agua destilada libre de aluminio y dilúya hasta 100 ml.
⦁ Solución de Tinción de Trabajo: diluya 10 mL de solución de tinción de reserva previamente preparada con agua destilada libre de aluminio hasta un volumen final de 100 ml.
Curva de calibración de aluminio
Prepare 7 patrones de aluminio de concentración: 0.00, 0.06, 0.12,0.18, 0.24, 0.30, 0.36 y 0.42 mg /L de aluminio, colocando los siguientes volúmenes: 0.00, 0.6, 1.2, 1.8, 2.4, 3.0, 3.6 y 4.2 ml, respectivamente de solución patrón estándar de aluminio de concentración de 5 mg / L, en balones aforados de 100 ml y afore con agua destilada libre de aluminio, tome una alícuota de 25 ml de cada uno de los patrones y coloquela en balones de 50 ml (estos pasan a se los nuevos patrones de trabajo), agregue a cada patrón 1 ml de ácido sulfúrico 0,02N, y mezcle. Añada a cada patrón 1 ml de solución de ácido ascórbico, 10 ml de solución tampón de acetato de sodio, 5 ml de solución tinción de trabajo, afore los balones a 50 ml y agite, Sirva cada uno de los patrones en celdas espectrofótometricas de vidrio de 2.5 cm de ancho y espere un tiempo de reacción de 10 minutos. Lea absorbancia en el espectrofotómetro DR 5000 , a una Longitud de onda de 535 nm, use como blanco el patrón N°1 de concentración 0.00 mg /L.
Construya una curva de calibración graficando Absorbancia versus concentración (mg/L) de aluminio.
Curva de calibración Absorbancia versus concentración (mg/L) de aluminio
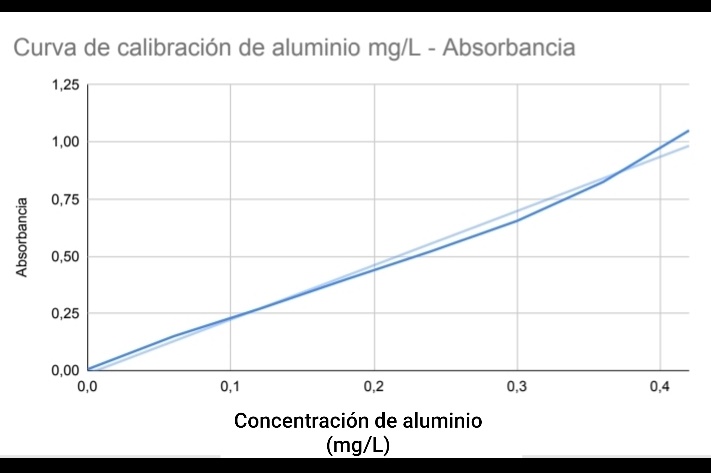
Fuente: El autor
Nota: Esta curva de calibración fue elaborada con datos aproximados para describir el comportamiento del fenomeno en estudio.
Por medio de esta curva se relacionan de forma lineal las variables implícitas en el fenómeno en estudio, basándonos en los fundamentos de la ley de Beer-Lambert, y se obtienen las ecuaciones y datos necesarios para determinar la concentración de una muestra problema futura de concentración desconocida, que se encuentre dentro de los valores del rango de aplicación de la misma.
Procedimiento de análisis
⦁ Tome 25 ml de muestra, use de 4 a 5 gotas de indicador mixto naranja de metilo, y titule con ácido sulfúrico H2SO4 0.02 N, hasta obtener un cambio de color de azul a rosa pálido, registre la lectura (esta lectura representa la cantidad de ácido sulfúrico H2SO4 necesario para neutralizar la alcalinidad presente en la muestra) y descarte la muestra.
⦁ Tome dos alícuotas independientes de 25ml de la muestras a analizar en dos balones aforados, añada a ambas a temperatura ambiente la misma cantidad (lectura registrada) de ácido sulfúrico H2SO4 0.02 N empleado en la neutralización anterior más 1 ml en exceso.
⦁ Añada un 1 ml de solución de solución de EDTA a una de las muestras esta servirá como blanco.
⦁ Añada a cada una de las muestras 1 ml de solución de ácido Ascórbico.
⦁ Añada a cada una de las muestras 10 ml de solución tampón de acetato de sodio.
⦁ Añada a cada una de las muestras 5 ml de solución tinción de trabajo.
⦁ Sirva cada uno de los patrones en celdas espectrofótometricas de vidrio de 2,5 cm de ancho.
⦁ Espere un tiempo de reacción de 10 minutos.
⦁ Léase la absorbancia en el DR 5000, a una longitud de onda de 535 nm, usando como blanco la muestra a la que le agrego solución de EDTA.
⦁ Determine la concentración de aluminio en la muestra por medio de la curva de calibración previamente preparada.
Análisis de las muestras con su respectivo blanco

Fuente: El autor
Cálculos
Calcule la concentración (mg/L) de aluminio en la muestra por medio de las siguientes ecuaciones y datos aportados por la curva de calibración:
mg/L de Aluminio = (Abs-b) / m
donde:
b = intersepto (mínima absorbancia posible)
m = pendiente de la recta
A = absorbancia
la presencia de fluoruros se corrige una vez medida la concentración de fluoruro por el método respectivo, con la gráfica de curvas de corrección de aluminio en presencia de fluoruro 3500 Al:1, gráfica aportada por el método estándar de referencia principal.
curvas de corrección de aluminio en presencia de fluoruro 3500 Al:1
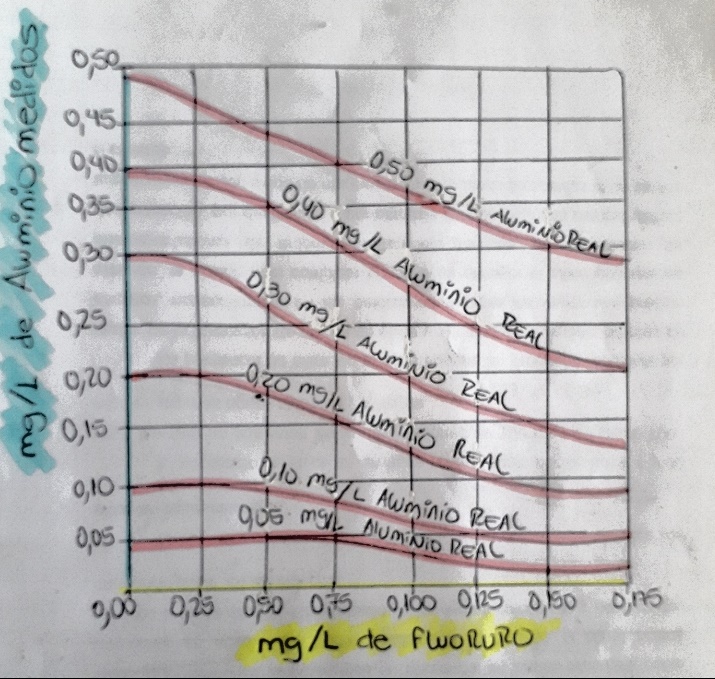
Fuente: el autor
Por encima de los mg/L de fluoruro, localizar el punto de mg/L de aluminio medidos, interpolar a partir de este punto subiendo hasta la curva más cercana.
Ejemplo: una muestra de concentración 0,10 mg/L de aluminio medidos, con presencia de 1,0 mg/L de fluoruro, posee una concentración real de 0,20 mg/L de aluminio.
Una vez determinado el valor de concentración de aluminio de la muestra de interés se ha dado un paso en la caracterización de la fuente en estudio, en pro de tomar las decisiones correctas para el adecuado tratamiento y la clasificación de la misma.
Me despido, esperando el tema abordado sea de utilidad y de agrado a la comunidad en general. @ISISFEMALE
Referencias:
APHA- AWHA- WEF 21 st Edición, Año 2005. STANDARS METHODS FOR THE EXAMINATION OF WATER AND WASTEWATER.
@ISISFEMALE, 2020. DETERMINACIÓN DE HIERRO EN AGUA NATURAL Y POTABLE POR MÉTODOS CLORIMÉTRICOS.
Herramienta de contenido visual:
Las fotos son de mi autoría, tomadas con la cámara de un teléfono samsung J400M, Androide 9.0 y editadas con la aplicación galería Samsug Electronic Co.,Ltd.
Las imágenes de cálculo y gráficas son de mi autoría, realizadas y editadas por la herramienta Excel de microsoft oficce 2013.

Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app
app and including @stemsocial as a beneficiary to get a stronger support.
Congratulations @isisfemale! You have completed the following achievement on the Hive blockchain and have been rewarded with new badge(s) :
You can view your badges on your board and compare yourself to others in the Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPBuen aporte @isisfemale. La principal vía de ingestión de aluminio es el agua para consumo y los complejos fluoruroaluminados pueden ser un poderoso riesgo para la salud. Por lo que es importante el control de este parámetro, así como el de otros metales, en el agua potable. Si me permites, te recomendaría arreglar los subíndices en las fórmulas de los compuestos para una mejor presentación. Saludos!
Hola @emiliomoron, así es. Gracias, me gusta mucho el análisis de agua. Estaré compartiendo otros aportes 😬, acepto recomendaciones. Lo de los subíndices se me dificultó ya que cree el documento en wordpad, pero sé que es importante esa observación. Vi alguno de tus aportes y están muy buenos. 🎀