Introduction
In this article we are going to examine one of the most widespread and often fatal types of neoplasia, I chose to bring this specific example because in previous articles have been given the molecular basis to better understand the mechanism of formation of this type of neoplasia, they are available on my blog and the articles concerned are as follows.
Mutations underlying familial and sporadic colon tumors
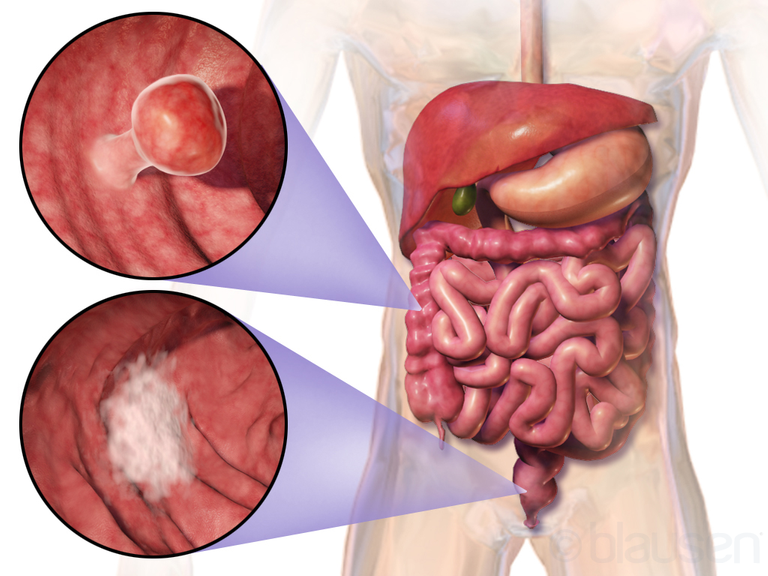
Colon tumors have been extensively studied over the years to try to identify a time scale of mutations that affect healthy cells in the mucosa of the colon, initially causing pre-neoplastic lesions that can lead to the formation of carcinoma.
Different proteins are involved in this process that are involved in different biological processes. Among these very important is the protein b-catenin which has a dual role: on the one hand, it mediates the mechanisms of contact inhibition being part of the multiprotein complex that binds caderins to actin complexes, on the other hand, it is part of a transcriptional complex able to activate genes with a pro-pro-proliferative function.
However, b-catenin is normally inhibited by a protein complex composed of APC, Axin (a structural protein) and kinases which allow phosphorylation to promote ubiquitinization and its elimination.
APC mutation, found both in sporadic tumours and in familial polyposis of the colon (a disease characterized by the formation of numerous polyps, some of which may evolve into carcinomas), causes the maintenance of the proliferative attitude of the cells of the colon's villi.

In fact, although APC is present in all cells, a mutation of APC causes more problems at the colon level due to the particular organization of the mucosa of the colon. The colon is, in fact, composed of the villi, where the differentiated cells are present in continuous exchange, and the crypts where the stem cells are present.
At the level of the crypts acts a growth factor, WNT (produced by the stromal cells), which allows the disassembly of the b-catenin inactivation complex, thus allowing the cells to proliferate.
Thus, cells, called trasmaplifying, are formed and directed towards the villus surface away from the WNT production source, which causes the loss of mitogenic activity and their differentiation.
If APC is mutated the cells maintain the proliferative potential even when they reach the surface of the villus, causing the formation of tumor masses; the mutation of APC is a recessive mutation from loss of function, therefore it requires a double mutational blow with loss of heterozygosity.
The same phenotypic result can be achieved through other mutations, including overespression of b-catenin or the presence of b-phosphorylated b-catenin, the presence of excess WNT or mutations of axin.
Of course, as with most cancers, other proteins are also involved in the genesis of colon cancer, including p53 (an oncosuppressant that allows the control of DNA damage) and other oncogenes such as Ras (a protein belonging to the MAP-kinases in degrees of attacking packages of genes needed for tumor growth).
In addition to these proteins, other proteins involved in different biological processes may also be mutated. In the case of Lynch's syndrome (hereditary non-polypomatous colon cancer syndrome), the genes involved in the mechanism of repair of mismatch** errors are mutated.
These errors can occur in any part of the genome, but preferentially occur in microsatellite regions (characterized by the repetition of a single base or a base pair). In the case of this syndrome, mutations occur in microsatellite regions contained in the gene for the TGF-B** receptor which will result in a lack of oncosuppressive signaling, and at the level of the gene for the BAX** proapoptotic protein, resulting in inactivation.
That said, following anatomopathological and genomic studies, the researchers concluded that two mutational pathways are preferentially involved in the genesis of colon tumors.
The first mutational pathway, which involves sporadic tumors and familial polyposis, initially involves a mutation that generally affects APC, then is mutated Ras and finally p53.
In reality the situation is more complex, however, this is because it has been discovered that it is essential to sequentially modify certain biological processes, but the way they are mutated is irrelevant. Therefore, even if the first mutation tends to fall on APC (80% of cases), mutations can also be found at the level of axin, b-catenin or WNT such as to lead to the same end result. The same goes for the other mutations, in fact, instead of Ras there can be mutations at other points of the signal transduction cascade; while instead of p53 it can be changed, for example, MDM2.
The second mutational pathway, on the other hand, is the basis of Lynch syndrome and initially involves a mutation of the genes coding for mismatch repair systems. This leads to the instability of micro satellites with mutations at the level of TGF-B, BAX and BRAF.
Pictures
Sources
Introduzione
In questo articolo andremo ad esaminare una delle tipologie di neoplasie maggiormente diffuse e con esito spesso fatale, ho scelto di portare questo specifico esempio perchè negli scorsi articoli sono state date delle basi molecolari per poter comprendere al meglio il meccanismo di formazione di questa tipologia di neoplasia,esse sono reperibili sul mio blog e gli articoli interessati sono i seguenti.
Mutazioni alla base dei tumori al colon familiari e sporadici
I tumori al colon sono stati ampiamente studiati nel corso degli anni per cercare di individuare una scala temporale delle mutazioni che vanno a colpire le cellule sane della mucosa del colon, causando inizialmente lesioni pre-neoplastiche che possono portare alla formazione di carcinoma.

In questo processo sono coinvolte diverse proteine che sono coinvolte di diversi processi biologici. Fra queste molto importante è la proteina b-catenina la quale ha un duplice ruolo: da un lato, infatti media i meccanismi di inibizione da contatto essendo parte del complesso multiproteico che lega le caderine ai complessi di actina, inoltre, fa parte di un complesso trascrizionale in grado di attivare geni con funzione pro-proliferativa.
La b-catenina è però normalmente inibita da un complesso proteico composto da APC, dall’Axina (una proteina strutturale) e da chinasi che permettono la fosforilazione così da favorire l’ubiquitinizzazione e l’eliminazione della stessa.
Una mutazone di APC, riscontrabile sia in tumori sporadici sia nella poliposi familiare del colon (patologia caratterizzata dalla formazione di numerosi polipi parte dei quali possono evolvere in carcinomi), causa il mantenimento dell’atteggiamento proliferativo delle cellule dei villi del colon.

Infatti, nonostante APC sia presente in tutte le cellule, una sua mutazione causa maggiori problematiche a livello del colon a causa della particolare organizzazione della mucosa dello stesso. Il colon risulta, infatti, essere composto dai villi, dove sono presenti le cellule differenziate in continuo ricambio, e le cripte dove invece sono presenti le cellule staminali.
A livello delle cripte agisce un fattore di crescita, WNT (prodotto dalle cellule stromali), che permette il disassemblamento del complesso di inattivazione della b-catenina, permettendo così alle cellule di proliferare.
Si formano così cellule, chiamate trasmaplificanti, che si dirigono verso la superficie del villo allontanandosi dalla fonte di produzione del WNT, questo determina la perdita dell’attività mitogena ed il differenziamento delle stesse.
Se APC è mutata le cellule mantengono il potenziale proliferativo anche quando giungono alla superficie del villo, determinando la formazione di masse tumorali; la mutazione di APC risulta essere una mutazione recessiva da perdita di funzione, perciò necessita di un doppio colpo mutazionale con perdita di eterozigosi.
Lo stesso risultato fenotipico può essere raggiunto tramite altre mutazioni, fra cui l’overespressione della b-catenina o la presenza di b-catenina non fosforilabile, la presenza di WNT in eccesso o mutazioni a carico dell’axina.
Naturalmente, come per la maggior parte dei tumori anche altre proteine sono coinvolte nella genesi del tumore al colon, fra queste troviamo p53 (oncosoppressore che permette il controllo dei danni al DNA) ed altri oncogeni come per esempio Ras (proteina appartenente alle MAP-chinasi in gradi di attacare pacchetti di geni necessari per la crescita tumorale).
Oltre a queste proteine, possono essere mutate anche altre proteine coinvolte in processi biologici diversi. Nel caso della sindrome di Lynch (sindrome ereditaria del tumore al colon non polipomatoso), ad essere mutati sono geni coinvolti nel meccanismo di riparazione degli errori dovuti al mismatch.
Questi errori possono avvenire in qualunque parte del genoma, ma preferenzialmente avvengono in regioni micro satelliti (caratterizzate dalla ripetizione di una singola base o di una coppia di basi). Nel caso di questa sindrome avvengono mutazioni in regioni microsatellite contenute nel gene per il recettore del TGF-B che determinerà una mancata segnalazione oncosoppressiva, e a livello del gene per la proteina proapoptotica BAX, determinandone l’inattivazione.
Detto ciò, in seguito a studi anatomopatologici e genomici, i ricercatori sono giunti alla conclusione che nella genesi dei tumori al colon sono coinvolte preferenzialmente due vie mutazionali.
La prima via mutazionale, che coinvolte i tumori sporadici e la poliposi familiare, prevede inzialmente una mutazione che generalmente colpisce APC, successivamente viene mutato Ras ed infine p53.
In realtà la situazione risulta, però essere più complessa, questo perché si è scoperto che è essenziale andare a modificare sequenzialmente determinati processi biologici, ma il modo in cui questi vengono mutati è irrilevante. Perciò, anche se tendenzialmente la prima mutazione ricade su APC (80% dei casi), si possono trovare anche mutazioni a livello dell’axina, della b-catenina o di WNT tali da portare allo stesso risultato finale. Lo stesso discorso vale anche per le altre mutazioni, infatti, al posto di Ras possono esserci mutazioni in altri punti della cascata di trasduzione del segnale; mentre al posto di p53 può essere mutato, per esempio, MDM2.
La seconda via mutazionale, invece, è alla base della sindrome di Lynch e prevede inizialmente una mutazione dei geni che codificano per i sistemi di riparazione dei mismatch. Questo comporta l’instabilità dei micro satelliti con mutazioni a livello di TGF-B, BAX e BRAF.

Immagini
Fonti
!discovery 40
This post was shared and voted inside the discord by the curators team of discovery-it
Join our community! hive-193212
Discovery-it is also a Witness, vote for us here
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app
app and including @stemsocial as a beneficiary to get a stronger support.