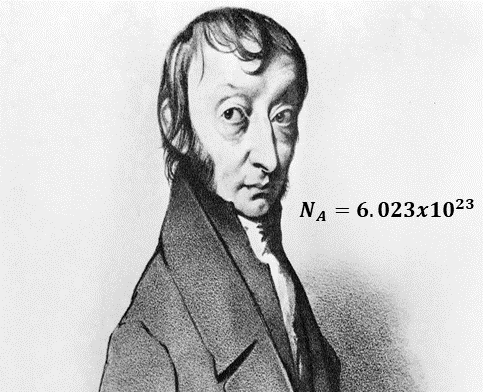
El número de Avogadro
El número de Avogadro recibe este nombre del físico y químico italiano Amadeo Avogadro, quien fue profesor de física de la universidad de Turín; sin embargo, este número el número se descubrió mucho tiempo después de este último, pero se le bautizó con su apellido, ya que fue él quien dijo que el volumen de un gas es proporcional al número de partículas que lo componen, conocida esta como ley de Avogadro, un ejemplo de esto es que 32 gramos de oxígeno (O2) tenía el mismo volumen que 28 gramos de nitrógeno (N2), para ese tiempo también se sabía que la masa de las moléculas era proporcional al número de partículas de cada gas, sabiendo esto el físico italiano tuvo la idea de que el número de partículas tenía que ser proporcional al volumen.
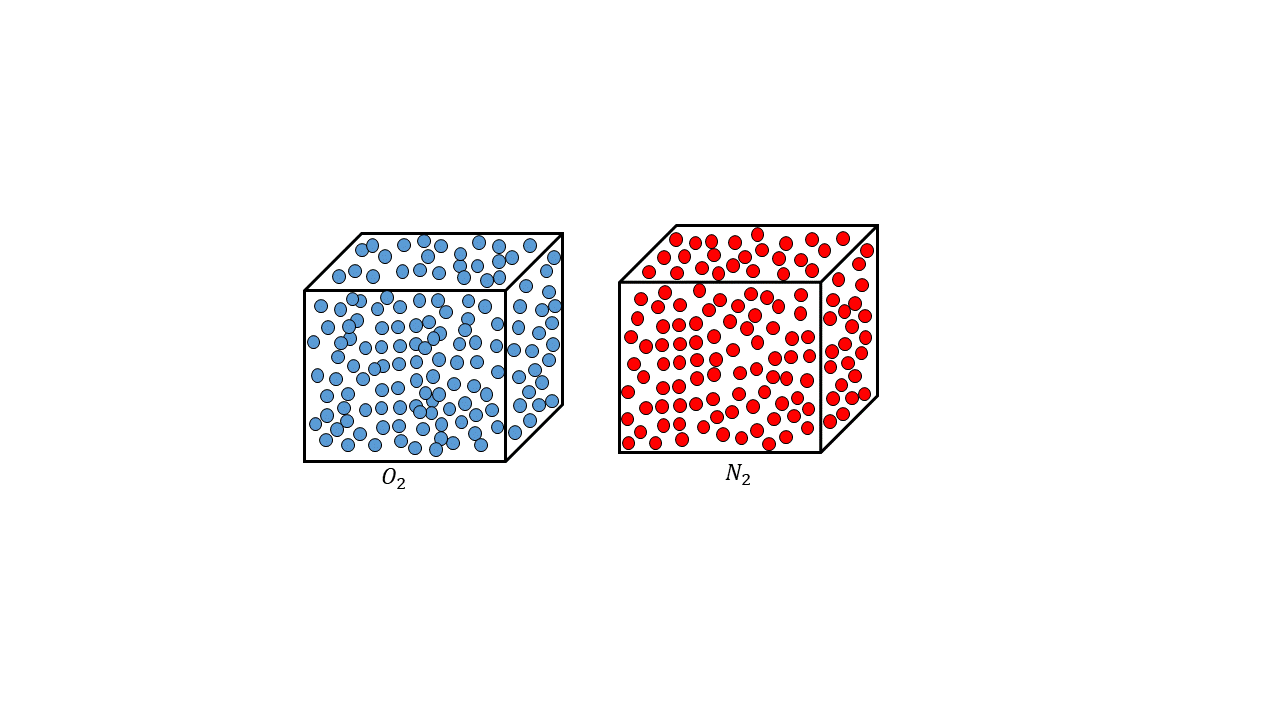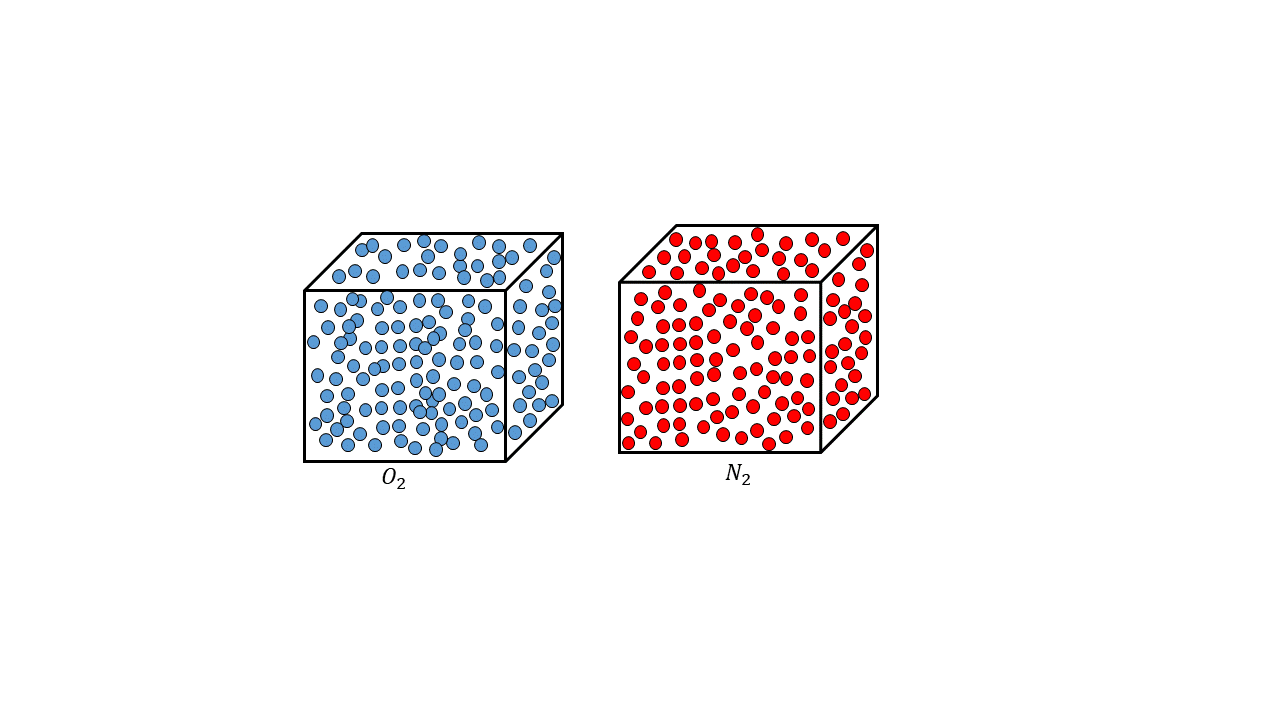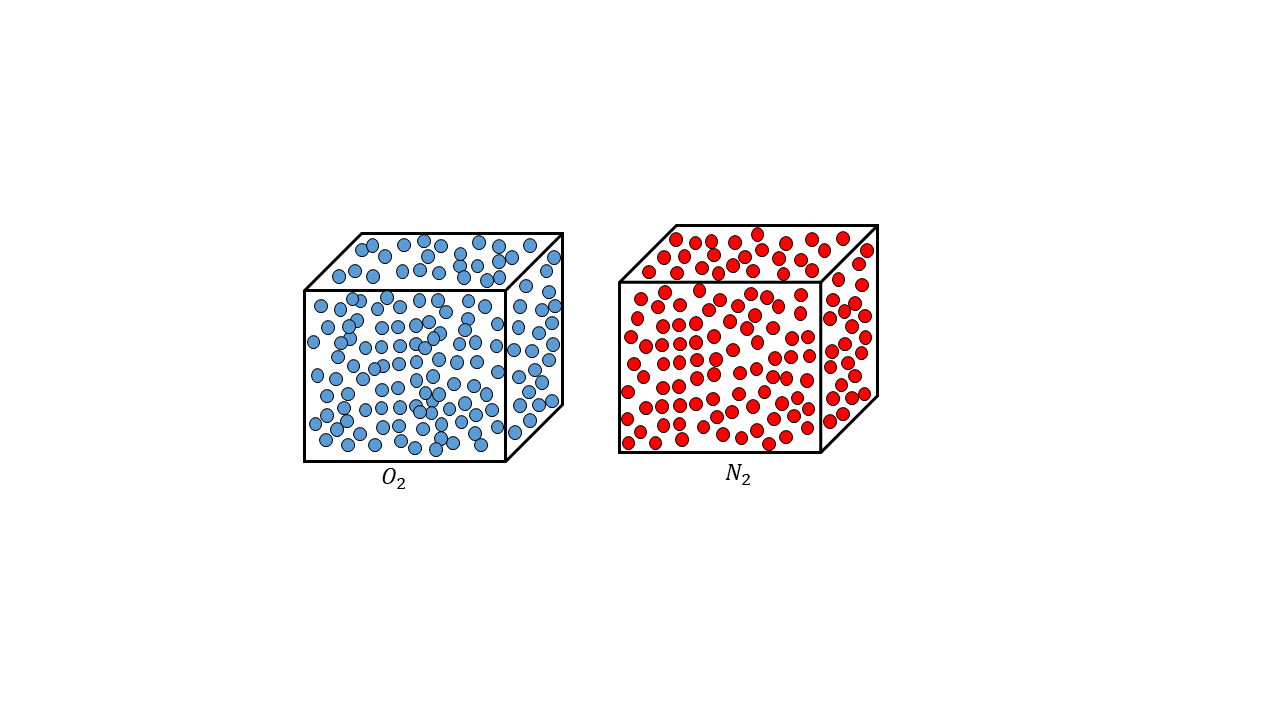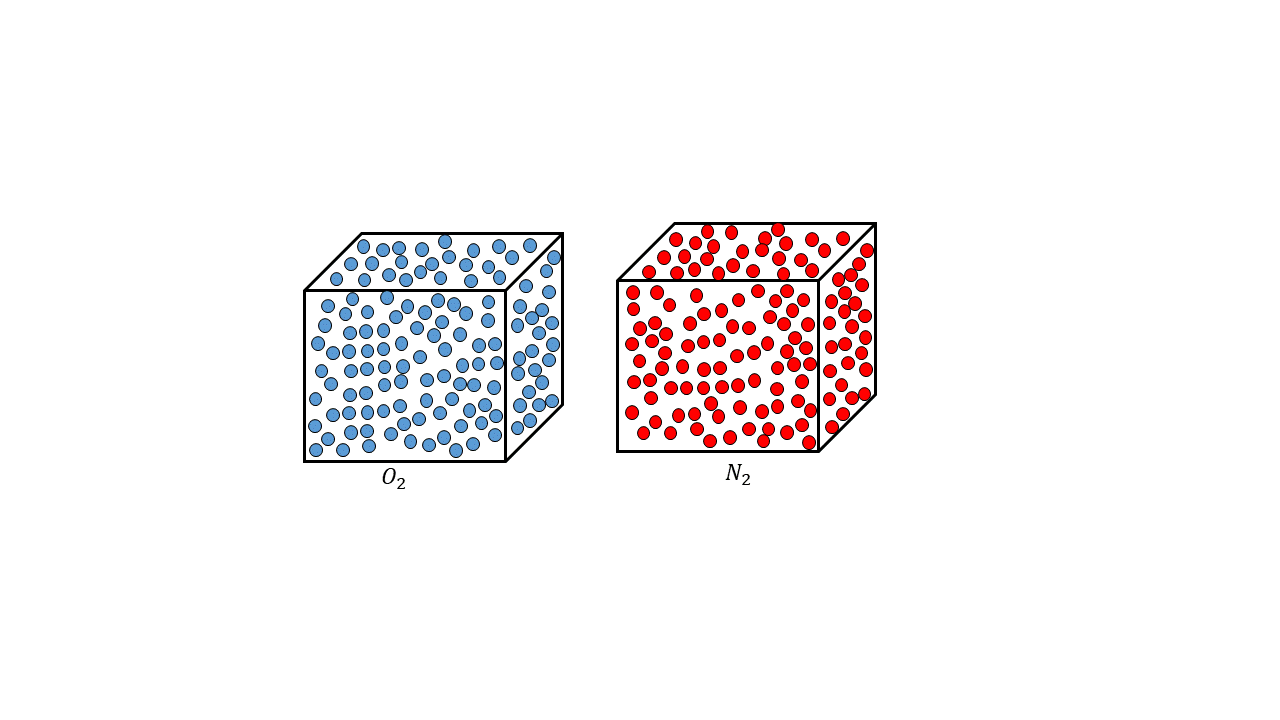
Esta idea de Avogadro era muy importante, ya que al involucrar la dimensión del volumen indicaba entonces que las moléculas o átomos tenían un tamaño determinado, sin embargo, ese número aún no estaba determinado. Años después en 1865 el físico austriaco Johan Loscmidt calculó el número de Loscmidt que es el número de partículas que hay en un número determinado de gas, esto se desarrolló mediante la termodinámica y la física estadística, específicamente la teoría cinética molecular, de tal manera que las partículas que había en un gas se podían contar por medio de estas ecuaciones, pero esto no estaba relacionado con el número de Avogadro como tal, pero ya esto daba las primeras aproximaciones para realizar este cálculo mediante la física matemática que se abría campo por medio de los trabajos de Losmidt.

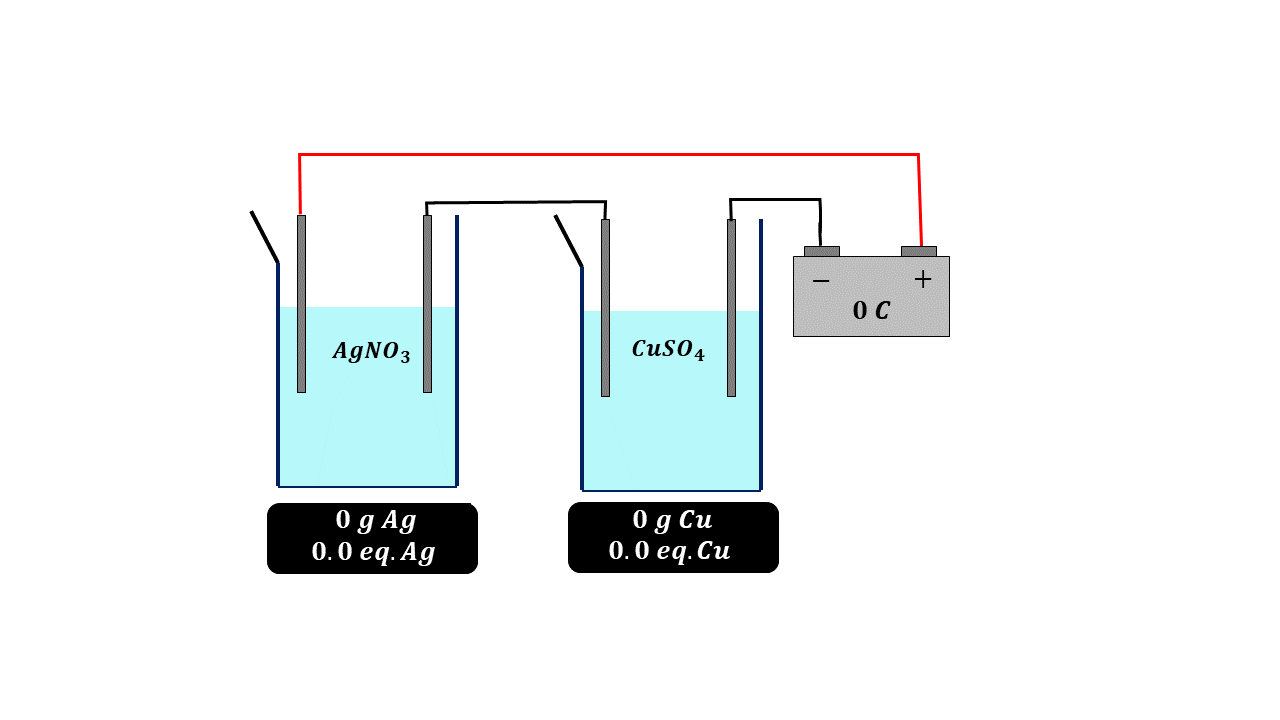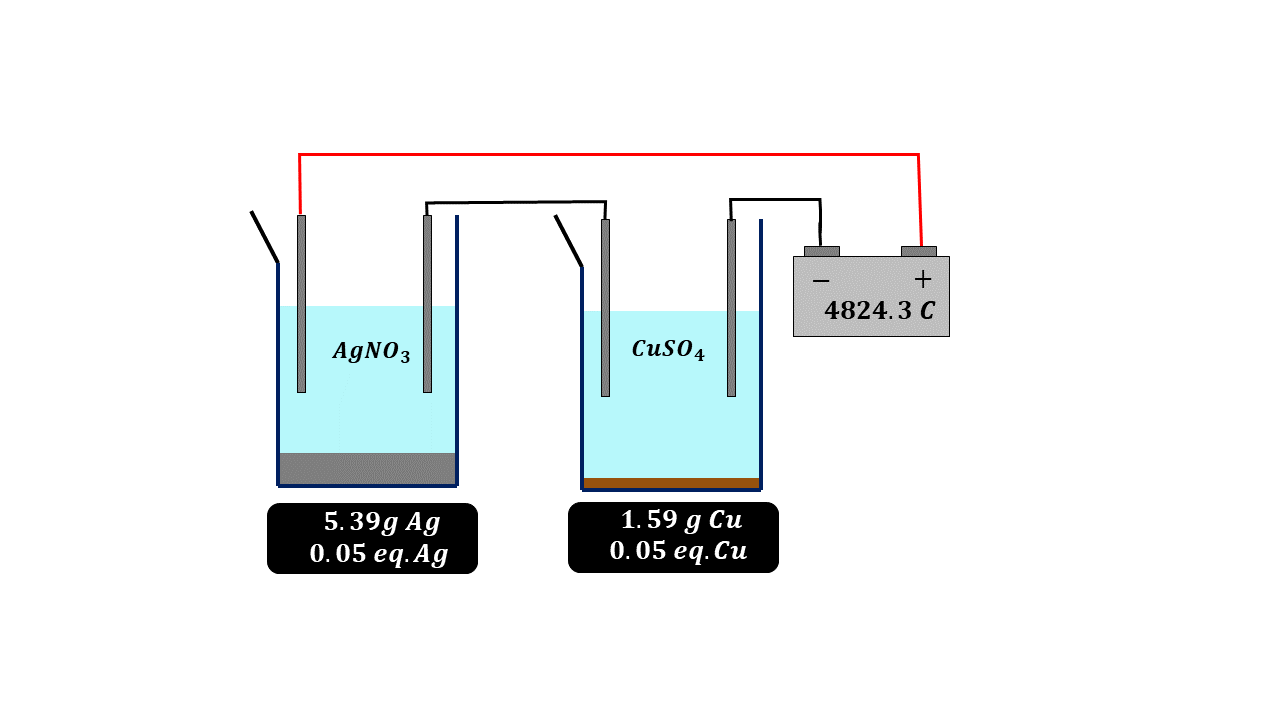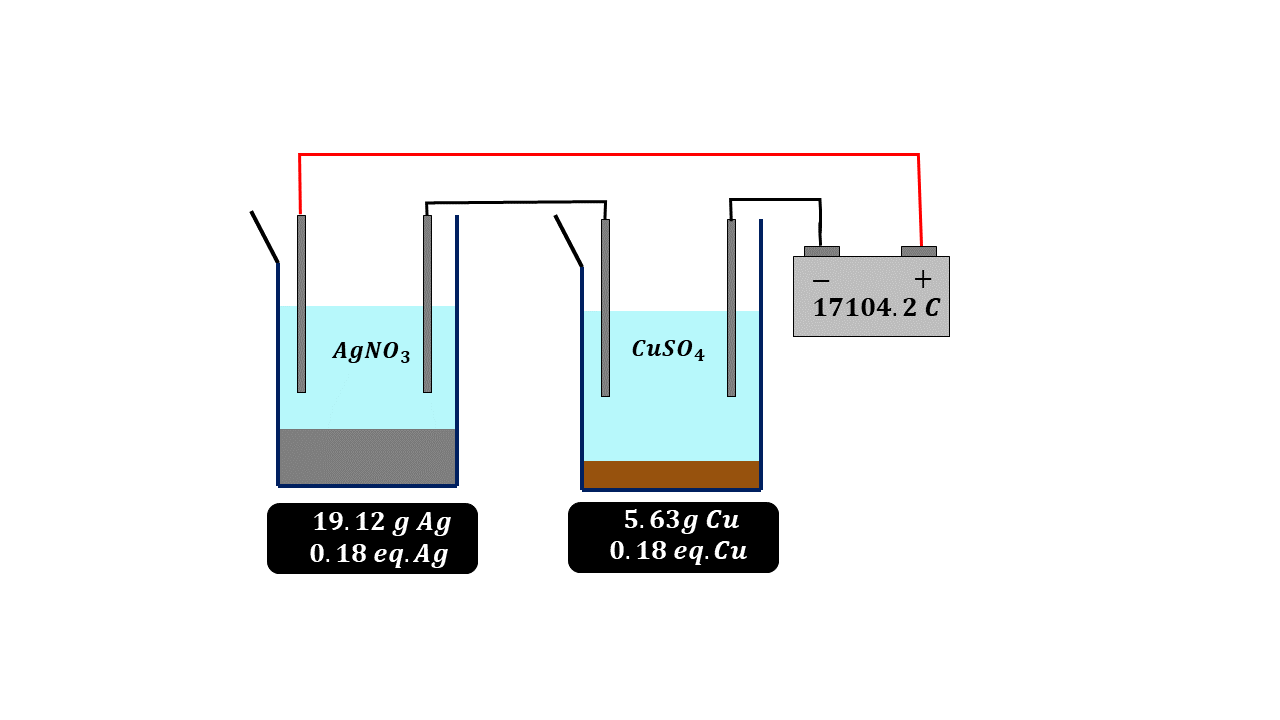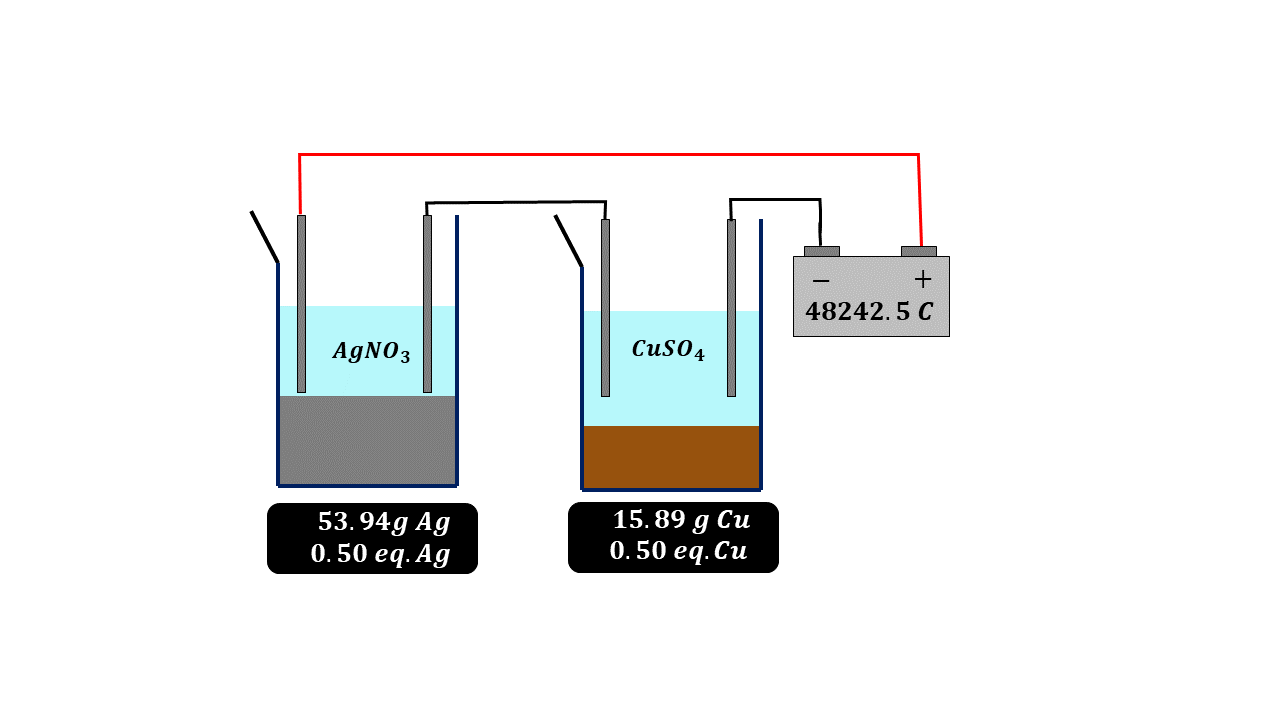
Paralelamente a esto se estaban haciendo una serie de experimentos muy importantes y a partir de los cuales se logra calcular el número de Avogadro que tanto usamos en nuestros cursos de química, termodinámica y física estadística. El primer valor determinado y que está relacionado con el concepto de mol fue descubierto en 1934 por el científico británico Michael Faraday quien halló la famosa constante de Faraday, de forma algo parecida a lo que acontecía con el volumen de los gases, es decir, la ley de Avogadro, Faraday se dio cuenta de que si dejaba pasar exactamente la misma carga eléctrica a través de una disolución de plata o de cobre la cantidad de cobre y plata que depositaba en peso, era equivalente a su peso equivalente, es decir, para una misma cantidad de carga eléctrica se depositaba más plata en peso que cobre, pero la cantidad de carga eléctrica era la misma, de tal forma que Faraday dedujo que esa carga eléctrica tenía también que ser proporcional a la cantidad de materia, como ya en esa época se conocía bien lo relacionado con las masas o pesos equivalentes entre sustancias, Faraday llegó a la conclusión que podía calcular una constante la cual tiene un valor de 96 485 colombios por cada equivalente de carga, en otras palabras, pasando esta cantidad de carga eléctrica depositaríamos exactamente 107.87 gramos de plata.

A principios del siglo XX, en 1905, Albert Einstein descubre la existencia de los átomos en función del movimiento Browniano, en esos momentos se estaba buscando la manera de conseguir el número de Avogadro por medio de otras vías.


El químico francés Jean Perrin hizo unos trabajos donde utilizó la física estadística, fue este químico quien bautizó por primera vez esa constante física como número de Avogadro, sin embargo, el valor exacto que usamos hoy fue realmente determinado por medio de un experimento desarrollado por el físico experimental Robert Millekan en 1909 quien con equipos bastante rudimentarios fue capaz de calcular la carga de un electrón.

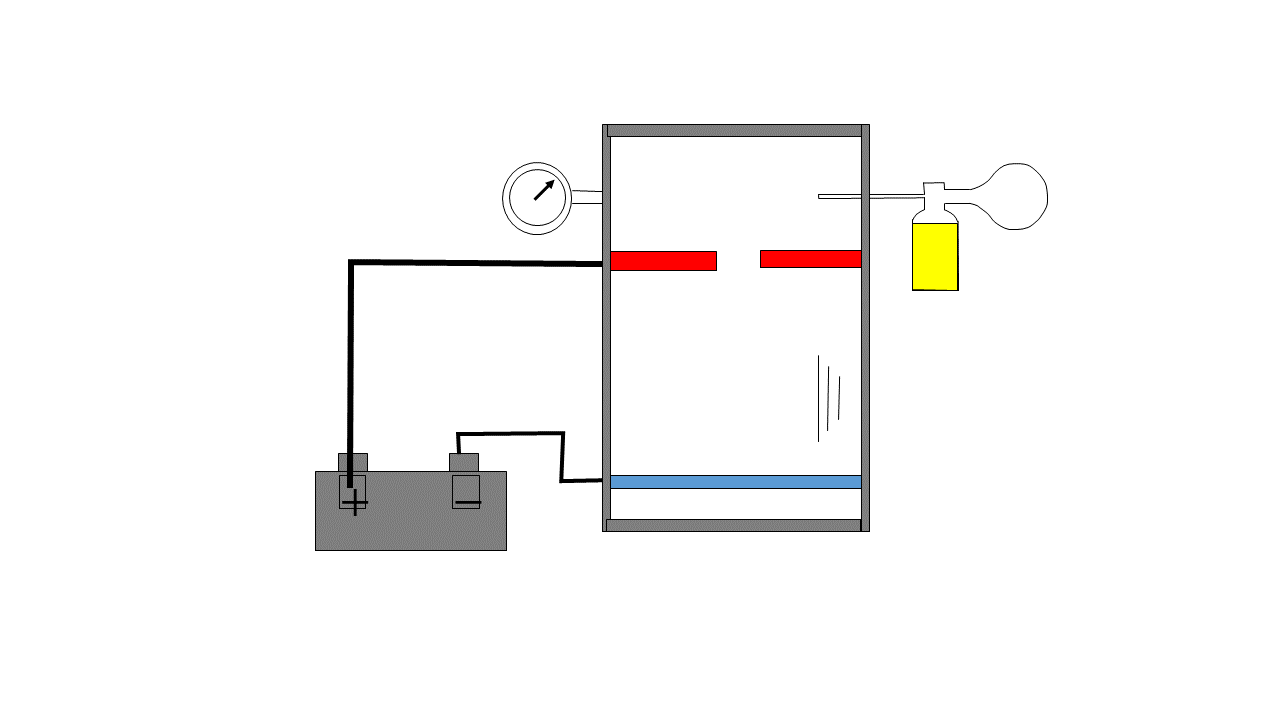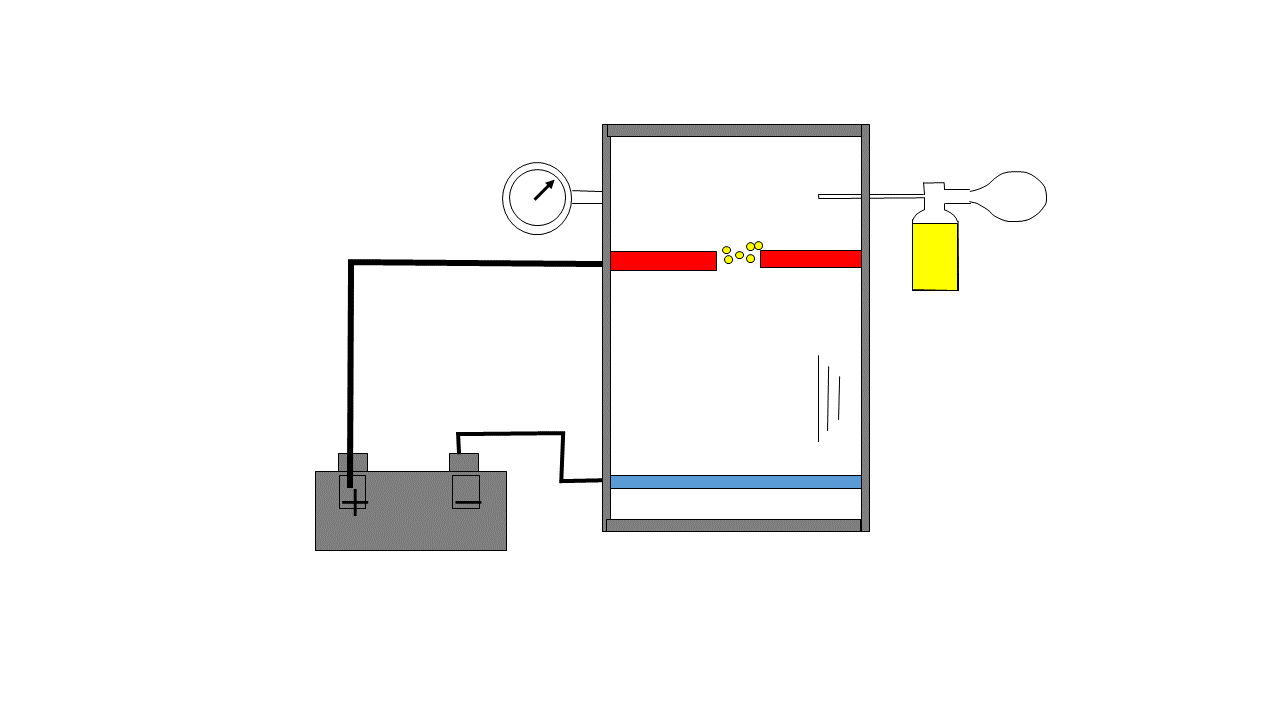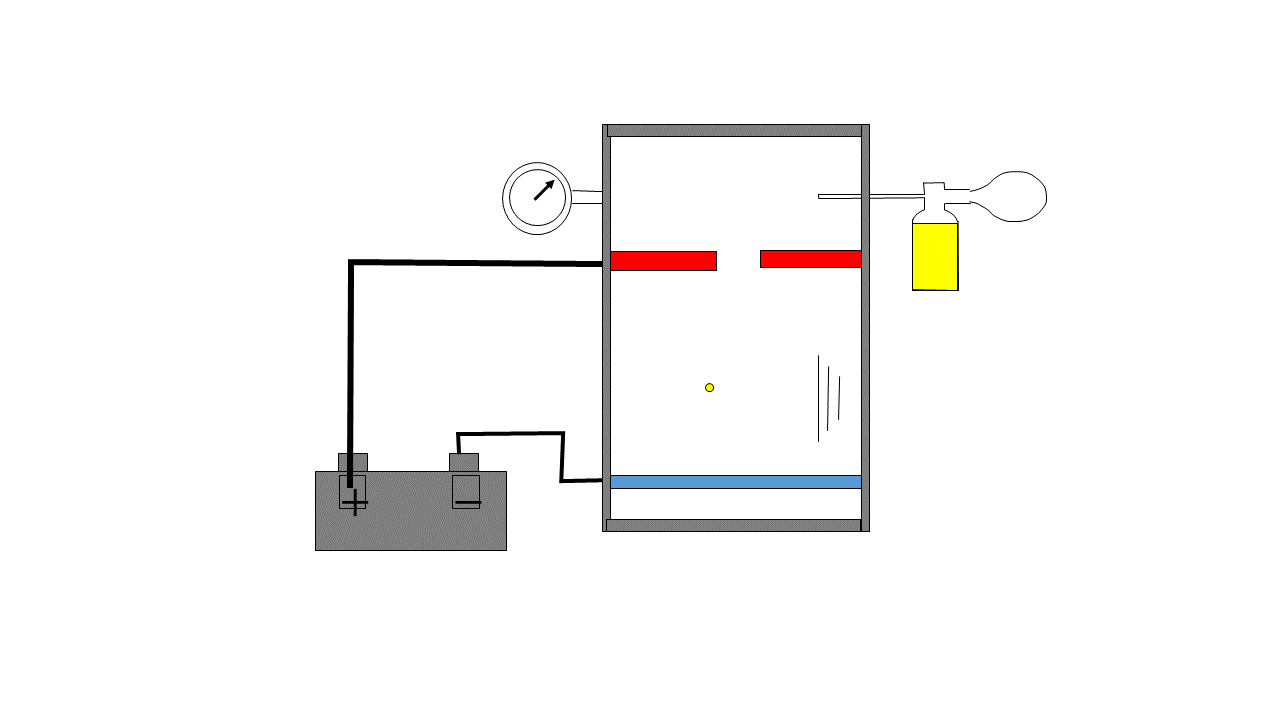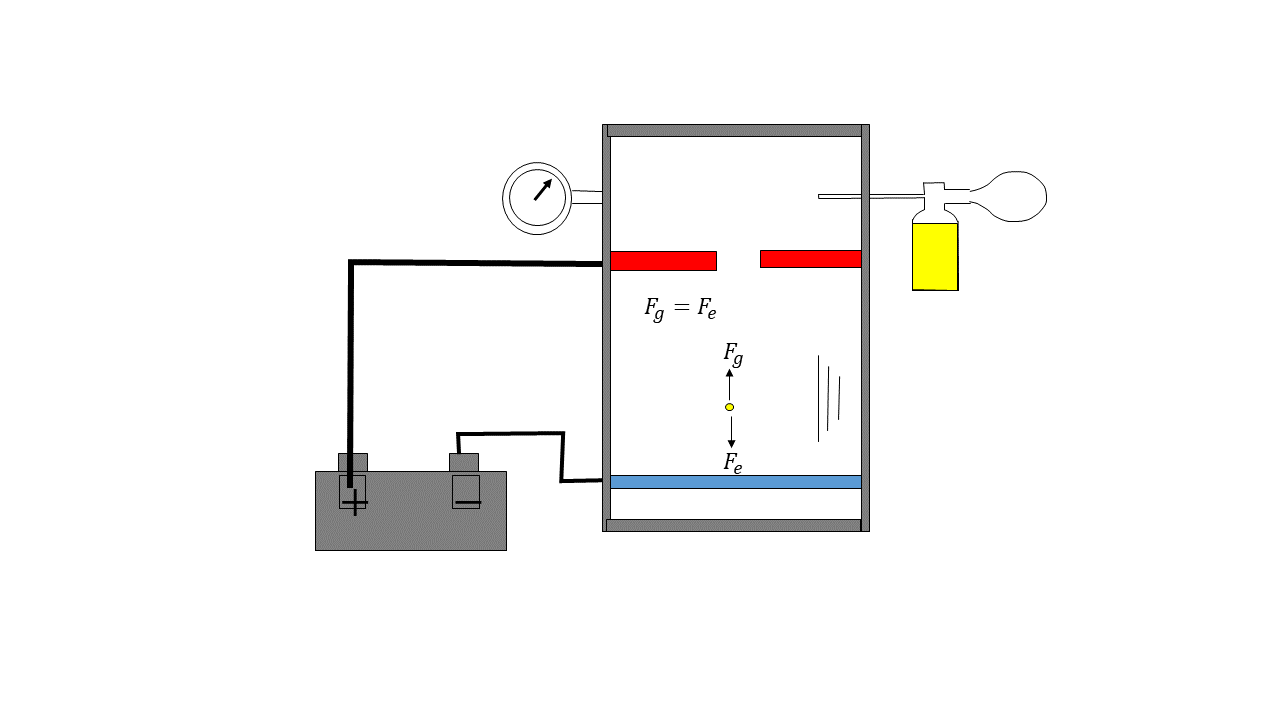
El experimento de Millikan es conocido como el experimento de la gota de aceite, este consistía en vaporizar gotas de aceite en una cámara que eran ionizadas eléctricamente, estas gotas caían por el efecto de la gravedad y en su caída pasaban por una zona con dos electrodos cargados y esta carga se regulaba para producir una fuerza eléctrica capaz de contrarrestar la fuerza gravitacional y la gota quedaba flotando de forma estable, Millikan anotaba la intensidad necesaria para que esa gota flotase y haciendo esto muchísimas veces se dio cuenta de que la carga siempre era múltiplo de un número cuyo valor absoluto era 1.6021E-19 Coulombios el cual es la carga del electrón.
De tal manera que entonces nos encontramos con dos constantes importantes, la constante de Faraday y la carga del electrón
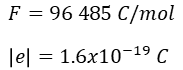
Con estos dos valores y sabiendo que para que se deposite un metal debe recibir un electrón y para que se deposite un equivalente de metal se debe recibir un equivalente de electrones, entonces tendremos el número de electrones en un equivalente, es decir, que si hacemos la división
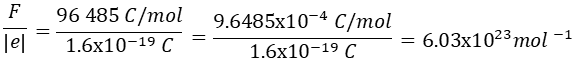
Y de esta manera se halla el valor del famoso número de Avogadro que usamos en la física y química desde el bachillerato.
Bibliografía
- Alonso M., Finn E. Física Volumen II: Campos y ondas. Addison Wesley Iberoamericana. Wilmington, 1987, págs 522-523.
- Hewitt Paul. Física conceptual 10ma. Ed. Pearson Addison Wesley. México, 2007, págs. 471-472.
- Sears F., Zemansky M., Young H. y Freedman R. Física Universitaria Vol. 2
Pearson Educación, Mexico 2005, págs 1029-1031.
Fuente de las imágenes
- Amadeo Avogadro: https://www.biografiasyvidas.com/biografia/a/avogadro.htm
- Jean Loschmidt: https://loschmidt.chemi.muni.cz/biography/
- Michael Faraday: https://en.wikipedia.org/wiki/Michael_Faraday
- Albert Einstein: https://es.wikipedia.org/wiki/Albert_Einstein
Todos los GIF fueron hechos por mí mediante el uso de Microsoft PowerPoint PPTRobert Millikan: https://es.wikipedia.org/wiki/Robert_Andrews_Millikan


!MEME
Credit: tanzil2024
Earn Crypto for your Memes @ HiveMe.me!