Entre los métodos de análisis volumétrico empleados en laboratorios para la determinación de la concentración de diversos analitos se encuentra la volumetría de precipitación, la cual se caracteriza por la reacción entre un agente precipitante y el analito para la formación de un precipitado o compuesto poco soluble.

Fuente: @yusvelasquez
A partir de la reacción química en la titulación, el volumen gastado de titulante y su concentración es posible realizar los cálculos necesarios y así determinar la concentración de una determinada especie.
En este post se presentará la resolución detallada de algunos casos de volumetría de precipitación empleando una valoración directa y una valoración por retroceso.
Comencemos con el primer ejemplo de valoración directa

Los cálculos constan de los siguientes pasos:
- Paso 1: Planteamiento del problema
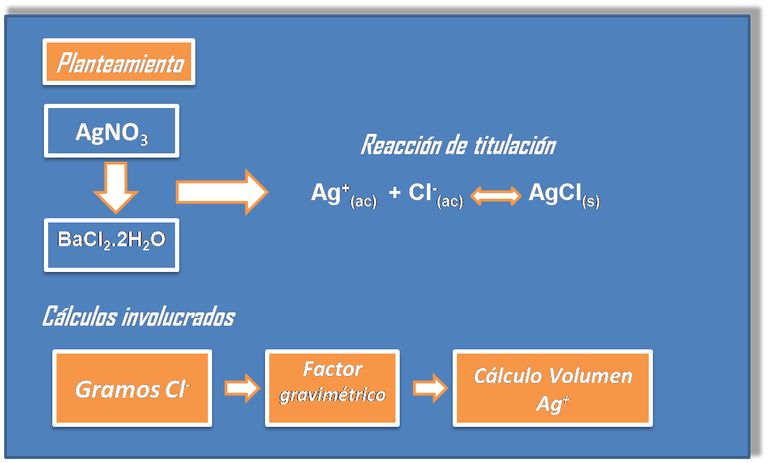
- Paso 2: Definición de incógnita
Se debe partir de la reacción de titulación en el punto de equivalencia. De la estequiometría de la reacción se deduce que:
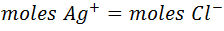
Los moles de Ag+ y los moles de Cl- vienen dados por:

De allí se tiene entonces la siguiente expresión, que permite calcular el volumen de agente precipitante requerido en la valoración.
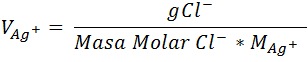
- Paso 3: Cálculo de los gramos de Cl-
Los gramos de cloruro se pueden calcular haciendo uso del factor gravimétrico a partir de los gramos de cloruro de bario
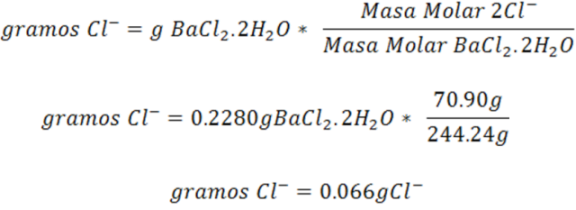
- Paso 4: Cálculo del volumen de plata
Se sustituyen los gramos de cloruro para determinar el volumen de nitrato de plata
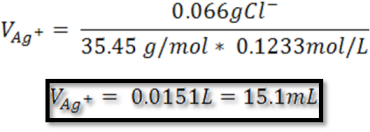
Es necesario adicionar 15.1mL de nitrato de plata para precipitar el cloruro contenido en la muestra.
En el siguiente caso se presenta una valoración por retroceso, en donde se agrega un exceso de titulante en la primera valoración, y la cantidad de agente titulante que no reacciona se valora frente a una segunda solución patrón de KSCN por lo que hay que tomar en cuenta las dos reacciones.

Los cálculos constan de los siguientes pasos:
- Paso 1: Planteamiento del problema
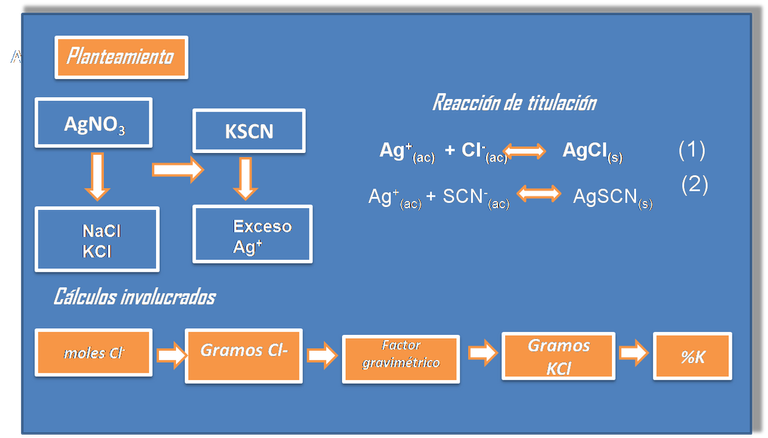
- Paso 2: Definición de incógnita
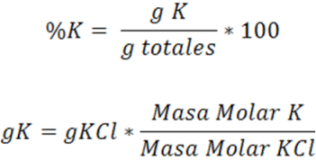
- Paso 3: Cálculo de los moles y gramos deCl-
Basados en las reacciones se tiene en el punto de equivalencia:

Por tanto,

- Paso 4: Cálculo de los gramos de KCl
En la primera titulación se tiene

Obteniéndose la ecuación 1
Por otra parte, los gramos de cloruros a partir del KCl y NaCl se pueden expresar de la siguiente forma:

Obteniéndose la ecuación 2, al resolver el sistema de ecuaciones se obtiene el valor de X y Y que corresponden a los gramos de NaCl y KCl respectivamente.
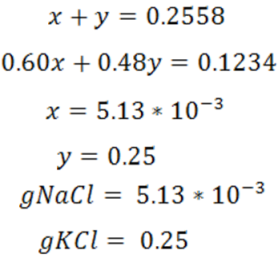
- Paso 5: Cálculo %K

Por tanto, la muestra contiene 6.54% de K.
Como vemos en este tipo de ejercicios es muy importante dominar la expresión y cálculo del factor gravimétrico, ya que permite determinar los gramos de analito, estableciendo una relación entre la sustancia pesada al final del método y la sustancia buscada. Por otra parte, hay que tomar en cuenta la estequiometría de la reacción, las concentraciones e identificar el tipo de valoración que se lleva a cabo para el tratamiento de los datos.
Hasta aquí el presente post. Espero les sea útil, gracias por leer.
Referencias
- Hamilton, Simpson y Elis (1988). Cálculos de Química Analítica. Mc Graw Hill
- Skoog, W.(2000) Química Analítica. Mc Graw Hill
- Harvey D., (2000) Química analítica moderna. Mc Graw Hill
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.