¡Hola amigos de la comunidad científica de Hive!
Tanto en la vida diaria como a nivel industrial resulta importante conocer las cantidades de las sustancias involucradas en un proceso determinado, así como también las cantidades que se pueden obtener a partir de ellas con la finalidad de sacar el máximo provecho y por el contrario evitar pérdidas.
En el hogar por ejemplo, si se desea cocinar una receta para un número determinado de personas es necesario conocer los ingredientes que se necesitan y las cantidades que se obtendrán para cumplir con los requerimientos, de igual manera en la producción industrial de alimentos, y cualquier otro productos, se deben realizar los cálculos en relación a los reactivos y productos que están involucrados en una reacción química.

Fuente: Imagen editada en power point con imágenes de dominio público:1,2
Desde el punto de vista químico, la estequiometría permite estudiar las relaciones cuantitativas entre los elementos y compuestos cuando experimentan cambios químicos. Es un campo muy amplio en donde se deben dominar una serie de conceptos, sin embargo, en este post nos enfocaremos en los cálculos estequiométricos más utilizados que se basan en las reacciones químicas.
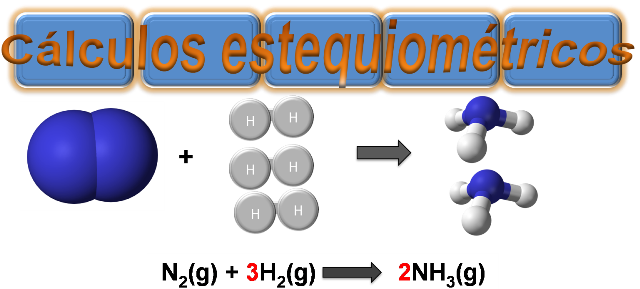
Imagen realizada en power point con imágenes de dominio público:1:2
Comencemos con los cálculos mol a mol
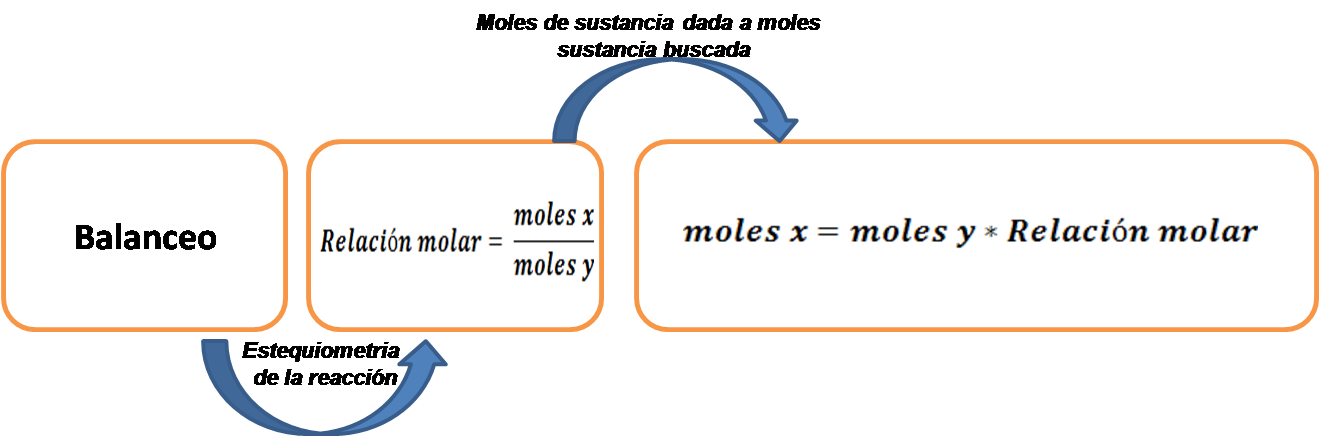
En este caso el objetivo es calcular los moles del compuesto deseado que se forma a partir de los moles de un compuesto dado; se basa en el uso del factor unitario y la interpretación del ajuste de la reacción química. Para realizar este tipo de cálculos se pueden seguir los pasos que se muestran a continuación:
En primer lugar, se debe escribir la ecuación química de la reacción y verificar que esté correctamente balanceada, en caso contrario debe ajustarse.
Establecer la relación molar entre las especies indicadas para escribir el factor de conversión, el cual relaciona la sustancia buscada (X) con la sustancia dada (Y) de esta manera se convierte la cantidad de una sustancia en la cantidad de otra expresada en moles.
Con la relación molar se procede a calcular los moles de producto.
Fuente:@yusvelasquez
Veamos el siguiente ejemplo
Ejemplo 1: ¿Cuántos moles de NH3 pueden producirse a partir de la reacción de 2 moles de H2?
La reacción es:

Como se puede observar la ecuación no está balanceada, por lo que inicialmente se procede a ajustarla por tanteo, en este caso se puede adicionar el coeficiente 2 al compuesto NH3 para ajustar los átomos de nitrógeno posteriormente se adiciona el coeficiente 3 al compuesto H2 del lado izquierdo de la reacción para ajustar los átomos de hidrógeno, quedando la reacción balanceada de la siguiente manera:
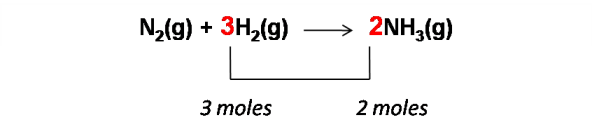
De la reacción se deduce que 3 mol de H2 produce 2 moles de amoníaco.
La relación estequiométrica en este caso se expresa como:
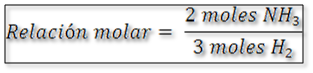
Una vez determinada la relación estequiométrica se puede calcular los moles de amoníaco producidos.
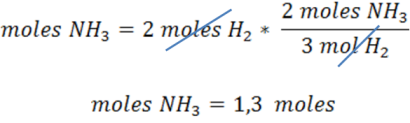
Como vemos este tipo de cálculos son sencillos y directos donde se debe interpretar la estequiometría de la reacción.
Cálculos masa a masa
En este caso el objetivo es calcular la masa de la sustancia buscada que se forma a partir de los gramos dados. Para realizar este tipo de cálculos se pueden seguir los pasos que se muestran a continuación:
En primer lugar, se debe escribir la ecuación química de la reacción y verificar que esté correctamente balanceada.
Seguidamente los gramos de la sustancia dada se convierten en moles empleando la masa molar del compuesto.
Convertir los moles de la sustancia dada en moles de sustancia buscada empleando la relación molar tomando en cuenta la reacción balanceada.
Finalmente convertir los moles de la sustancia buscada en gramos empleando la masa molar.
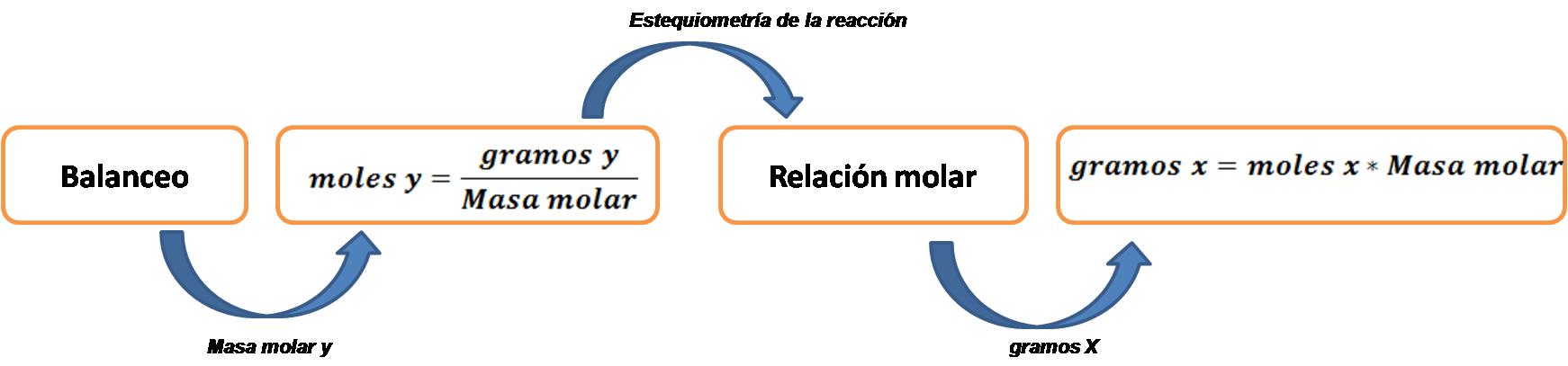
Fuente:@yusvelasquez
Veamos el siguiente ejemplo
Ejemplo 2: ¿Cuántos gramos de potasio son necesarios para reaccionar con 0.450 gramos de hidrógeno gaseoso para producir hidruro de potasio KH?
La reacción es:
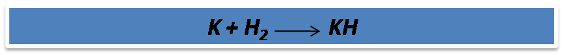
Como se puede observar la ecuación no está balanceada, por lo que inicialmente se procede a ajustarla por tanteo, en este caso se puede adicionar el coeficiente 2 al compuesto KH para ajustar los átomos de hidrógeno posteriormente se adiciona el coeficiente 2 al compuesto K del lado izquierdo de la reacción para ajustar los átomos K, quedando la reacción balanceada de la siguiente manera:
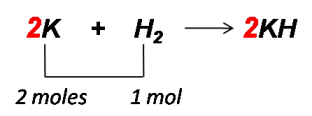
Seguidamente se calculan los moles de H2 empleando su masa molar.
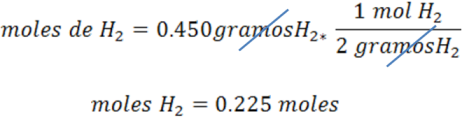
Se calculan los moles de K empleando la relación molar. De la reacción se deduce que 2 mol de K reaccionan con 1 mol de H2
La relación estequiométrica en este caso se expresa como:
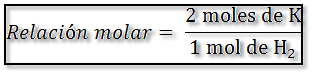
Por lo tanto el cálculo de los moles de K es:
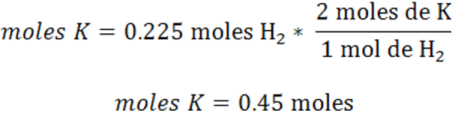
Finalmente se convierten los moles de K en gramos empleando la masa molar.
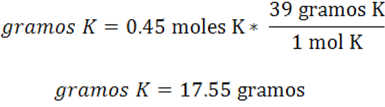
En este caso son necesarios 17.55 gramos de K para que reaccionen con 0.450 gramos de hidrógeno y formar KH. Cabe destacar que los factores unitarios o la relación entre las sustancias pueden escribirse en moles o en gramos basados en la reacción química ajustada.
Como vemos los cálculos estequiométricos se pueden realizar siguiendo los pasos descritos y las conversiones correspondientes, que permitirán optimizar los procesos.
¡Hasta una próxima oportunidad, gracias por leer!
Referencias
- Atkins, J. (2006). Principios de Química. Los caminos del descubrimiento.
- Whitten K. y Gailey, K. (1985). Química General. México: Nueva Editorial Interamericana
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.