¡Hola amigos!

Fuente:@yusvelasquez
Con los datos del peso de la muestra, el peso del precipitado, la estequiometría, masas molares o atómicas es posible realizar los cálculos que determinan la composición de la muestra o la cantidad de analito presente (sustancia buscada).
Los cálculos gravimétricos pueden ser directos o indirectos, por lo que resulta importante aprender el tratamiento de los datos en cada caso. En este post analizaremos algunos ejemplos de cálculos gravimétricos directos que no implican el uso de ecuaciones para obtener los gramos de determinado compuestos.
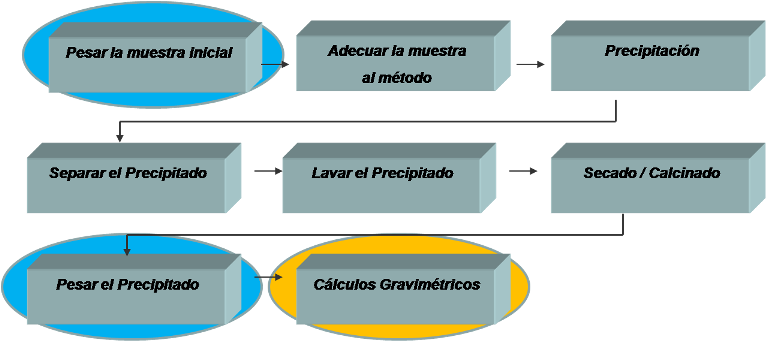
Pasos método gravimétrico:Fuente:@yusvelasquez
En gravimetría, la cantidad de analito presente en una muestra generalmente se expresa como % A, donde A corresponde al analito y se calcula por la siguiente ecuación:
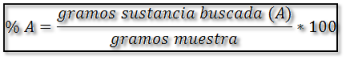
Ahora bien, ¿Qué pasa cuando la sustancia pesada no es directamente la sustancia buscada?
En los casos donde la sustancia pesada contiene o está relacionada con la sustancia buscada es necesario realizar una conversión para obtener los gramos de A.
Comencemos entonces a estudiar el factor gravimétrico (fg). Este factor convierte el peso del compuesto pesado en el peso de la sustancia buscada, depende de las masas molares de ambas sustancias y de los coeficientes estequiométricos que los relacionan.
Se puede definir como los gramos de analito presentes en un gramo del precipitado. En la expresión del factor gravimétrico, se debe tomar en cuenta que siempre debe colocarse en el numerador la masa atómica o molar de la sustancia buscada y en el denominador la sustancia pesada. El factor representa la estequiometría de la reacción que tiene lugar. Y viene dado por:
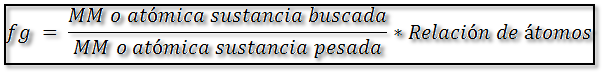
En la expresión del factor gravimétrico se debe igualar el número de átomos de un elemento que sea común en ambos términos. En el caso de que no exista un elemento común en el numerador y denominador, hay que buscar una relación estequiométrica entre ellos que puede resultar de uno o varios pasos de transformación de masa de uno en otro.
Es así que al multiplicar el peso del precipitado por el factor gravimétrico se obtienen los gramos de analito presente en la muestra:

Expresión del factor gravimétrico:
Algunos ejemplos de expresión de factor gravimétrico son los siguientes:
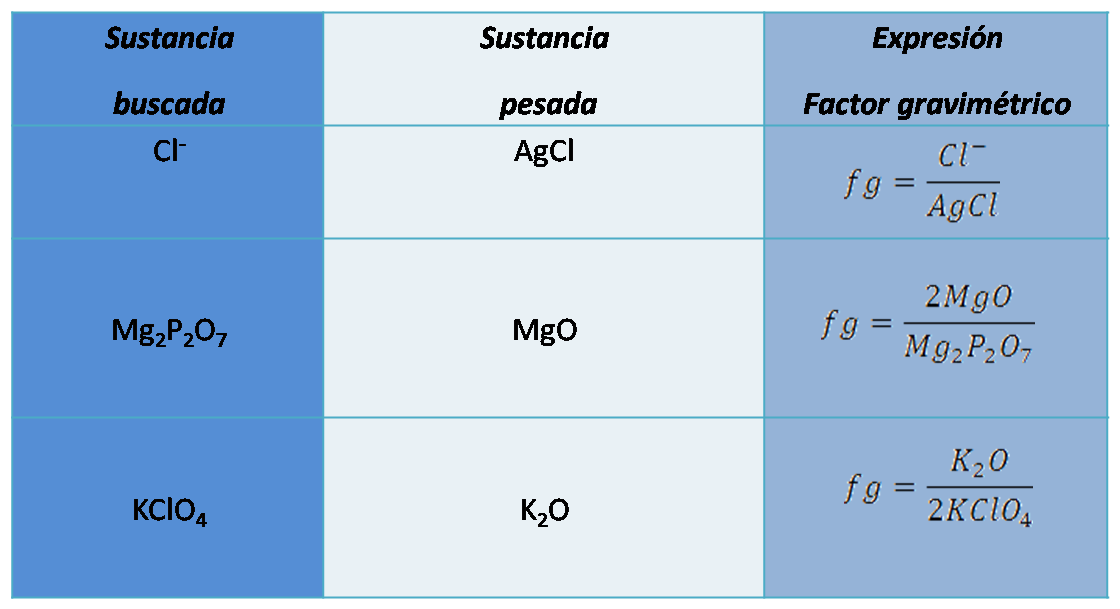
Como vemos en cada caso, las expresiones del factor gravimétrico contiene en el numerador la sustancia buscada y en el denominador la sustancia pesada ajustando los átomos con los coeficientes adecuados.
Analicemos algunos ejemplos de cálculos gravimétricos directos
Comencemos con un ejemplo sencillo donde se debe expresar el factor gravimétrico para calcular los gramos de A.
Cálculo gramos de A
Ejemplo 1: ¿Cuántos gramos de azufre hay en 5.6 gramos de sulfato de bario?
El planteamiento es el siguiente:
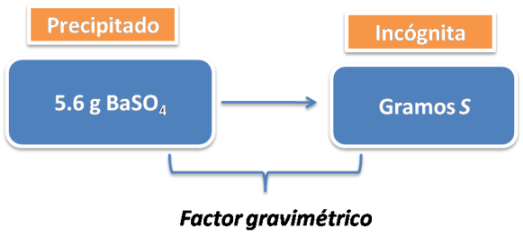
La ecuación para calcular los gramos de azufre es:
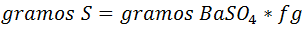
La expresión del factor gravimétrico viene dada por:
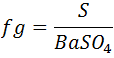
El cálculo de los gramos de S es:
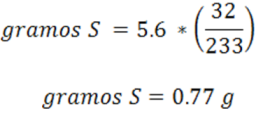
Veamos a continuación el caso donde se calcula el %A expresando el factor gravimétrico donde las dos sustancias están relacionadas.
Cálculo del % A
Ejemplo 2:
Una muestra impura de cloruro que pesa 0.4 gramos se trató con un exceso de nitrato de plata, obteniéndose la formación de un precipitado de cloruro de plata que pesó 0.733 gramos. Calcular el porcentaje de cloruro de potasio en la muestra.
El planteamiento es el siguiente:
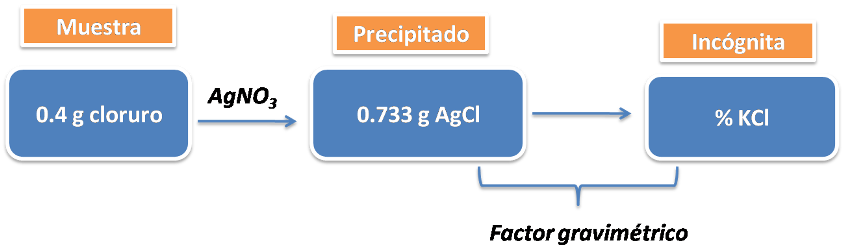
Como se puede observar en el planteamiento anterior la sustancia buscada es el KCl, por lo que la ecuación que se puede utilizar es la que se muestra:

Seguidamente se deben calcular los gramos de cloruro de potasio ya que la sustancia pesada (AgCl) no corresponde directamente con la sustancia buscada (KCl) por lo que pueden relacionarse por medio del factor gravimétrico de la siguiente manera:

Con esta información en este paso es posible calcular el porcentaje del cloruro de potasio en la muestra:
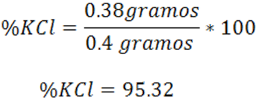
Resultando que la muestra impura contiene un 95.35% de KCl
Finalmente en el siguiente ejemplo se presenta el caso donde no existe relación directa entre el analito y la sustancia pesada por lo que debe buscarse una relación estequiométrica que incluyen varias expresiones.
Expresión del factor gravimétrico con varias relaciones.
Ejemplo 3:
Una muestra que contiene nitrógeno y pesa 0.25 gramos fue sometida al proceso de digestión con ácido sulfúrico concentrado, precipitando el (NH4)2PtCl6 que al calcinarlo se obtuvo un precipitado de Pt que pesó 0.088 gramos. ¿Cuál es el %N en la muestra?
El planteamiento es el siguiente:
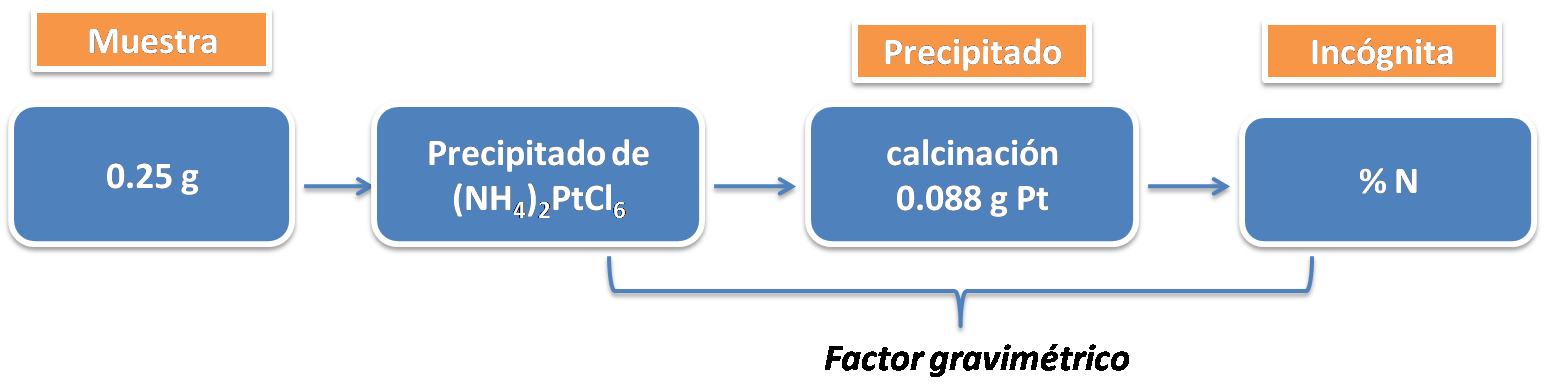
Los cálculos involucrados son:

El porcentaje de nitrógeno en la muestra es de 5.04
Conclusión
Los métodos de análisis gravimétricos son empleados en diferentes determinaciones analíticas como por ejemplo el análisis de aguas corrientes, aguas residuales y distintos iones por lo que es importante conocer tanto el procedimiento de laboratorio como el tratamiento de los datos para cuantificar la presencia del analito en la muestra.
Hasta aquí la información. ¡Gracias por leer!
Referencias
- Hamilton, Simpson y Elis (1988). Cálculos de Química Analítica. Mc Graw Hill
- Skoog, W.(2000) Química Analítica. Mc Graw Hill
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
You may also include @stemsocial as a beneficiary of the rewards of this post to get a stronger support.
¡Gracias por el apoyo!