"Jeżeli możesz zmierzyć to, o czym mówisz i możesz wyrazić to liczbą, wtedy znasz przedmiot swoich badań, ale jeżeli nie możesz tego zmierzyć, twoja znajomość jest uboga i niezadowalająca".
Myśl tę wypowiedział niegdyś Lord Kelvin i jesteśmy skłonni zgodzić się z nim. Wiemy przecież, że przy dodawaniu składników "na oko" może nawet nie udać się ciasto, a co dopiero reakcja chemiczna. Także, gdy chcemy oznaczyć ilość jakiegoś składnika za pomocą rozmaitych metod, najczęściej fizykochemicznych, musimy być przygotowani, że pewne wartości trzeba będzie mierzyć. A co właściwie mierzy chemik? Czytelnik na pewno odpowie na to pytanie, gdy przyjrzy się poniższym jednostkom miar. W większości przypadków są to tzw.jednostki SI (od francuskich słów Système International) wprowadzone i obowiązujące na świecie.
1) kg
2) Pa [m-1 * kg * s-2]
3) J [m2*kg * s2]
4) V [kg * m2 * A -1 * s-3]
5)ρ [kg * m-3]
Odpowiedzi:
Ad. 1
Waga analityczna jest niezbędnym przyrządem w każdym laboratorium. Ważąc określamy masę ważonej substancji i wyrażamy w gramach [g] bądź miligramach [mg], podczas gdy podstawową jednostka jest kilogram [kg]. Waga analityczna jest bardzo czułym przyrządem i należy się z nią bardzo umiejętnie obchodzić. Dlatego zwykle jest umieszczona w tzw. pokoju wagowym gdzie utrzymuje się stałą temperaturę i wilgotność i gdzie wagi umieszczone są na specjalnych konsolach - blatach wmontowanych w ściany konstrukcyjne budynku. Nie są wówczas narażone na jakiekolwiek wstrząsy, nawet te spowodowane stąpaniem po podłodze.
Rys. 1 Współczesna waga analityczna; waga analityczna używana do odważania leków w drugiej połowie XIX wieku w Londynie

Ad. 2
Manometrem mierzy się ciśnienie. Warto wiedzieć, że wiele reakcji chemicznych, zwłaszcza mających zastosowanie w przemyśle, przebiega z lepszą wydajnością pod zwiększonym ciśnieniem. Często spotykamy się z informacją dotyczącą zależności zachowania się ciał (np. wrzenie) i ich własności fizycznych od ciśnienia. Dawniej jednostką ciśnienia była atmosfera, obecnie wg SI, paskal [Pa]. 1atm = 1,01325 * 10 5 Pa
Rys. 2 Manometr; reduktor ciśnienia gazu

Ad. 3
Kalorymetr służy do pomiaru ilości ciepła wydzielonego lub pochłoniętego podczas różnych pomiarów fizykochemicznych. Posługując się tym przyrządem można wyznaczyć np. ciepło reakcji chemicznej czy ciepło rozpuszczania. Jednostką ilości ciepła była dawniej kaloria [cal], obecnie wg SI, jest nią dżul [J]. 1 cal = 0,41868 * 10 J
Rys. 3 Kalorymetr przepływowy Junkersa - służy do oznaczania ciepła spalania i wartości opałowej paliw gazowych; współczesny kalorymetr z bombą kalorymetryczną i jego podstawowe elementy

Ad. 4
Wolt jest jednostką siły elektromotorycznej. Prowadzi nas to bezpośrednio do urządzenia zwanego pehametrem, ponieważ oznaczanie za jego pomocą polega właśnie na pomiarze siły elektromotorycznej ogniwa. Jedna elektroda tego ogniwa zanurzona jest w roztworze o znanym pH, druga zaś w roztworze badanym. Dla wygody użytkownika pehametry podają od razu wyniki w skali pH, aby uniknąć przeliczania przez podstawianie do wzoru na zależność pH od siły elektromotorycznej. Oznaczenie pH daje nam informacje o odczynie roztworu. Wielkość pH jest niemianowana czyli niemająca jednostki miary.
Rys. 4 Pehametr; kwasomierz wykorzystywany do badania odczynu gleb
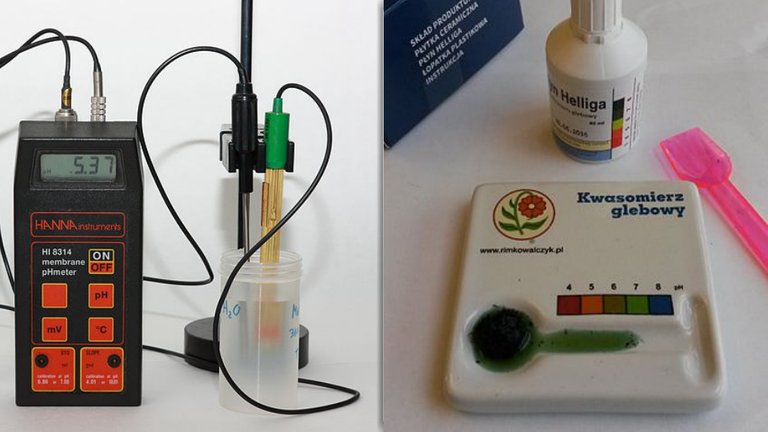
Ad. 5
Piknometr służy do oznaczania gęstości, wyrażonej w gramach na centymetr sześcienny. Jednostką przyjętą w układzie SI jest kilogram na metr sześcienny. Stosowanie jednak tak dużej jednostki w warunkach laboratoryjnych jest niewygodne, używa się więc jej tzw. podwielokrotności. Informując o gęstości jakiegoś ciała, podajemy zwykle przy symbolu tej wielkości wartość temperatury.
Rys. 5 Piknometr wypełniony niebieską cieczą; piknometr używany przez Dymitra Iwanowicza Mendelejewa w XIX w.; piknometr gazowy

Inne/ Others: Corrode znaczy zżerać; Sprzęt laboratoryjny
Źródła/ Sources:
Rys. 1 by:Kareljby:Wellcome Library
Rys. 2 by: by:eorihuela ;
Rys. 3 by:Turbojet ; by:Akshat Goel ; by:OpenStax
Rys. 4 by:SergeiGolyshev; by:Plogeo ; by:Frederico Abranches Quintão
Rys. 5 by:Slashme by:Serge Lachinov ; by:Станислав Мельников
Zaczerpnięte z: 500 zagadek chemicznych Marta Jurowska-Wernerowa; wyd. Wiedza Powszechna, Warszawa 1983