
Se cree que los hongos patógenos perjudican las células de sus hospederos causando enfermedad mediante la acción individual o combinada de cuatro mecanismos fundamentales de patogénesis: a) la producción y liberación de enzimas que degradan barreras celulares, b) la producción y liberación de sustancias toxicas que interfieren con el metabolismo de la planta, c) la producción y liberación de sustancias que interfieren con el control normal del crecimiento y desarrollo y d) la interferencia con los movimientos normales del agua, nutrientes y metabolitos [1].
Las enzimas son grandes moléculas proteicas que catalizan todas las reacciones interrelacionadas de una célula viva. Las enzimas que degradan las barreras celulares son consideradas en la patogénesis, debido a que estas facilitan la penetración y colonización del hongo a la célula del hospedante [1].
Los hongos necrotroficos producen enzimas que digieren los tejidos del hospedante, para luego utilizarlos como fuentes de alimentos. Entre estas enzimas están las peptinasas, que son responsables de la digestión de la lámina media, las celulasas, que digieren la pared celular, lipasas y proteasas que digieren los lípidos y proteínas, incluyendo a aquellos que forman la membrana celular y amilasas que degradan el almidón. La ligninasas es producida también por hongos capaces de degradar la madera. Las peptinasas son las más estudiadas de las enzimas involucradas en las interacciones hospedante-Patogeno. Estas incluyen las poligaracturonasas, la pectimetilesterasa entre otras.
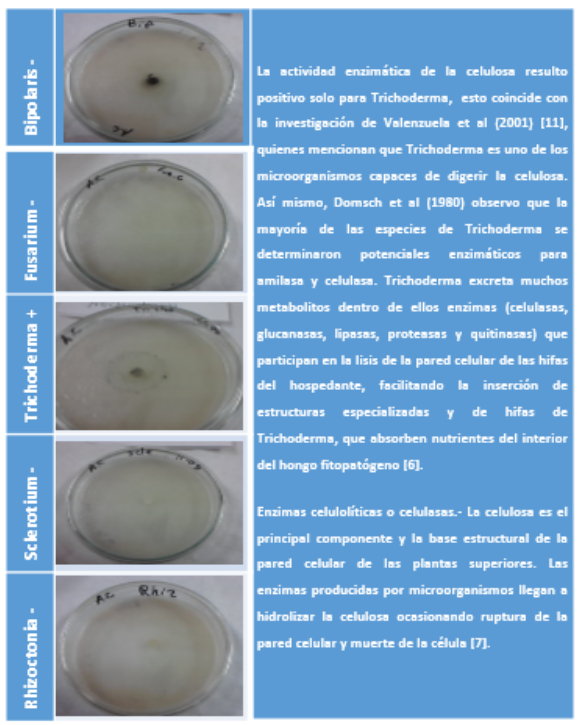
La celulosa es también un polisacárido, compuesto de moléculas de glucosa. La degradación enzimática de la celulosa da como resultado final la producción de moléculas de glucosa. Se ha demostrado que las enzimas que degradan a la celulosa (celulasas) con producidas por varios hongos fitopatogenos, permitiendo que el patógenos penetre y se propague en los tejidos del hospedante, causando la desintegración de la pared celular, lo que facilita el desarrollo de la enfermedad [2].
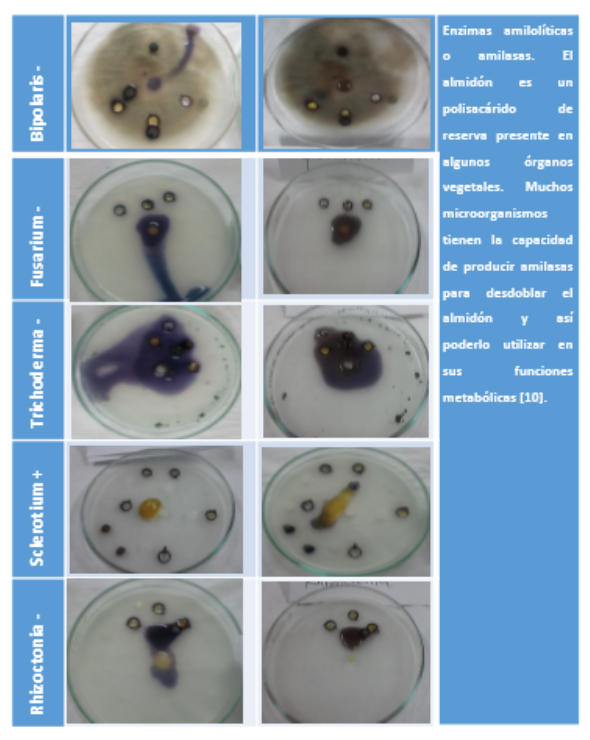
El almidón es el principal polisacárido de reserva que predomina en las plantas, es un polímero de glucosa y está compuesto de dos formas: amilosa, una molécula lineal esencial, y amilopectina, una gran molécula ramificada de varias cadenas cortas. La mayoría de los patógenos utilizan el almidón, y otras reservas de polisacáridos, en su actividad metabólicas. La degradación del almidón es llevada a cabo por la acción de enzimas llamadas amilasas.
Las paredes y membranas celulares contienen diferentes e innumerables proteínas, las cuales juegan diversos roles como catalizadores de reacciones celulares (enzimas) o como material estructural (en membranas y paredes celulares). Los aminoácidos, junto con las proteínas, son usualmente considerados principalmente como fuente de nitrógenos, aunque también pueden actuar como única fuente de carbono para algunos hongos [1].
La enzima tirosinasa o polifenoloxidasa (PPO, monofenol, o-difenol:oxígeno reductasa, presenta cobre en su molécula. Los sitios activos de la tirosinasa contienen dos átomos de cobre. La enzima cataliza la hidroxilación de monofenoles (actividad monofenolasa) y la oxidación de o-difenoles a o-quinonas (actividad difenolasa) [3].
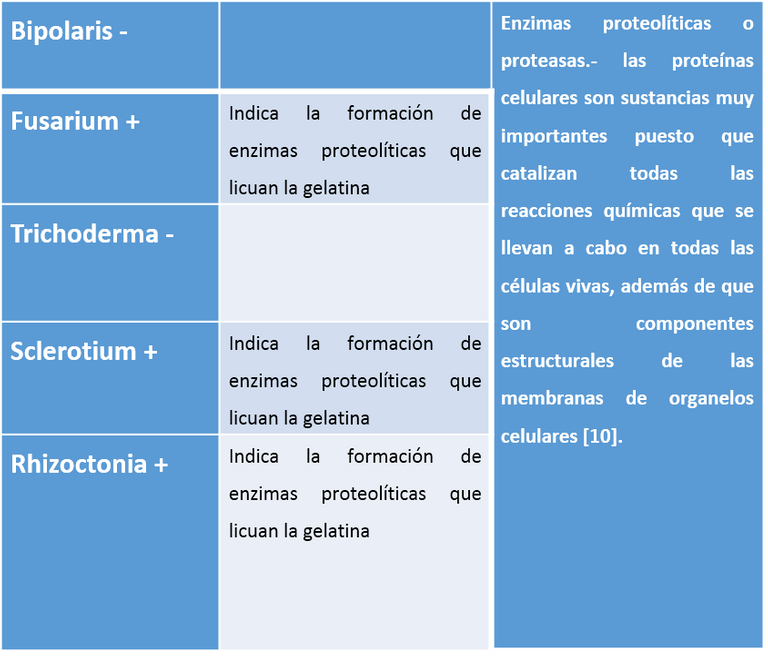
Las proteínas son naturalmente de tamaño y estructura muy poco asimilables por los microorganismos, por lo tanto deben ser catabolizadas por estos en componentes más pequeños para poder utilizarlos, las enzimas proteolíticas son secretadas por un gran número de microorganismos para el desdoblamiento de proteínas de allí que sean llamadas proteasas [4].
• Determinar cualitativamente la presencia de enzimas intracelulares y extracelulares producidas por diferentes hongos fitopatógenos, sobre medios de cultivos sólidos.
• Discutir la posible función de dichas enzimas durante el proceso de patogénesis, establecimiento de la infección y procesos nutricionales del hongo
Para todas las actividades evaluadas, se emplearon los sistemas de detección en placas. Esto se realizó en forma directa, observando las diferencias en la coloración o en la zona degradada con respecto al medio no hidrolizado y en todos los caso, se compararon la actividad con respecto a los testigos. Se siguió el procedimiento de Taylor (1974) y Stalpers (1978) [9].
Cuadro 1. Medios de cultivo

Cuadro 2. Medios de cultivos utilizados para la evaluación de las enzimas por medio de la observación de las diferencias de coloración.
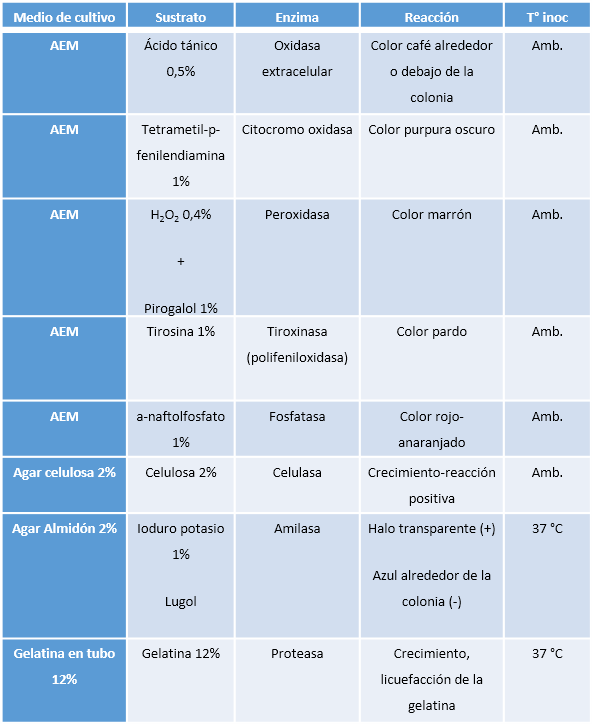
AEM: Agar Extracto de Malta, T° inoc: temperatura de incubación
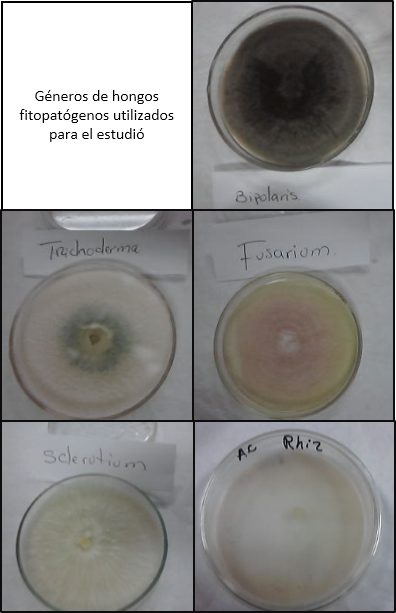
Cuadro 3. Géneros de hongos fitopatogenos utilizados para el estudio.
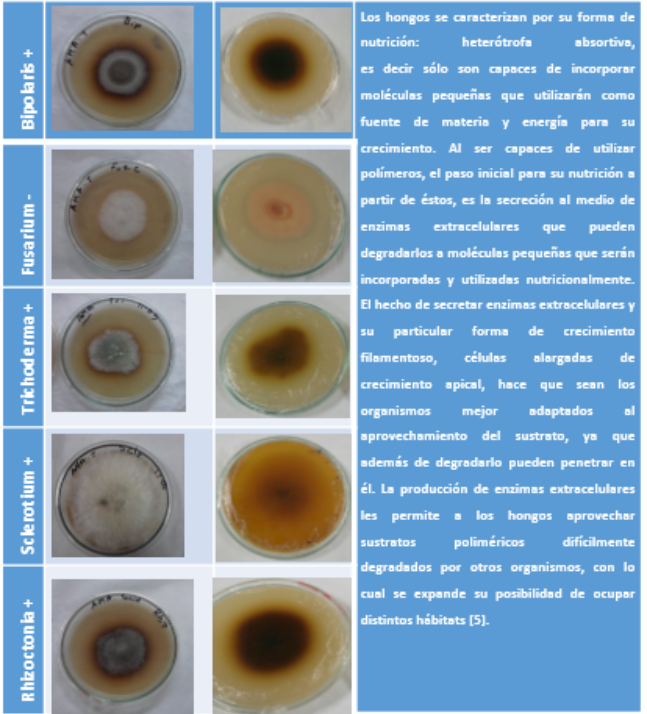
Cuadro 4. Detección cualitativa de la presencia de enzimas producida por los diferentes hongos fitopatógenos.
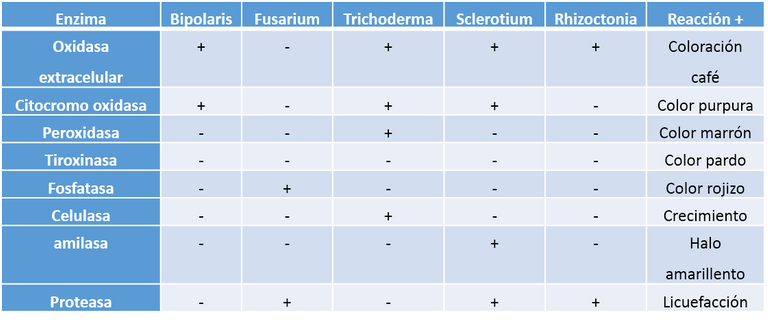
Cuadro 5. Oxidasa extracelular: Coloración café (+)
Cuadro 6. Citocromo oxidasa: Coloración purpura oscura (+)
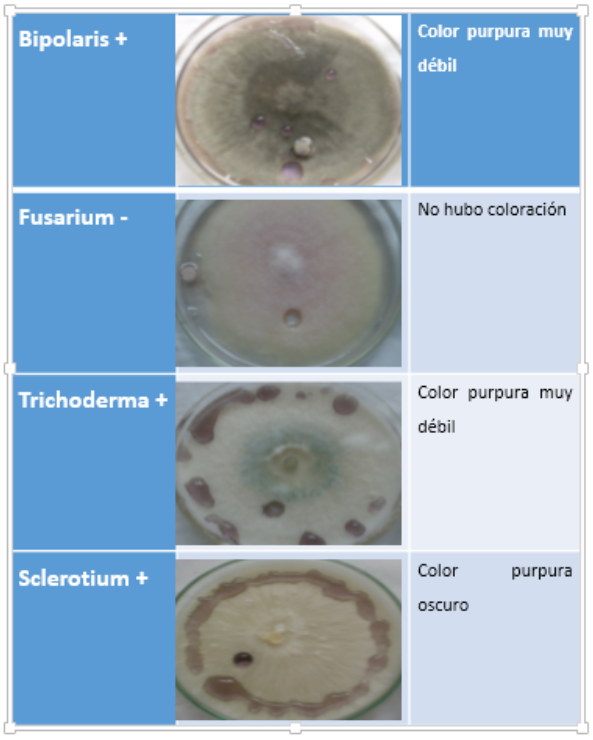
Cuadro 7. Peroxidasa Coloración marrón (+)
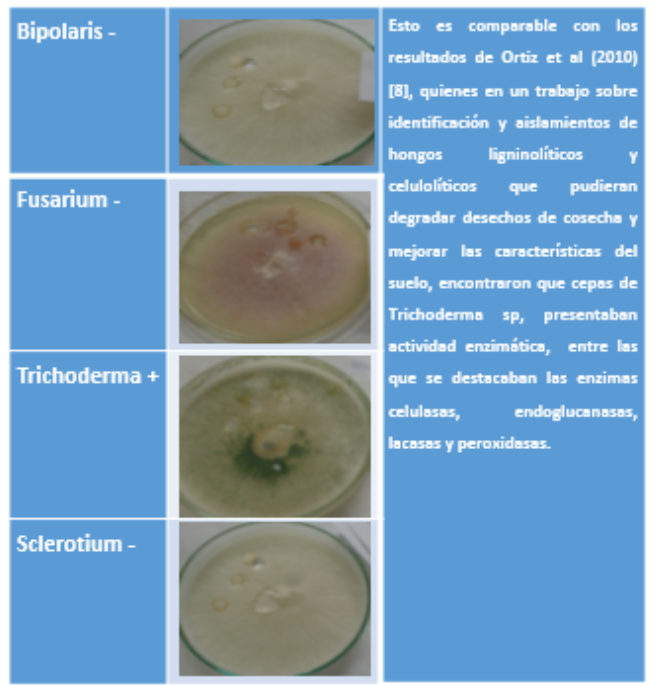
Cuadro 8. Celulasa: Crecimiento (+)
Cuadro 9. Amilasa. Halo marón transparente (+) Color violeta alrededor (-)
Cuadro 10. Proteasa: licuefacción de la gelatina
• Se determinó cualitativamente la presencia de enzimas intracelulares y extracelulares producidas por diferentes hongos fitopatógenos, sobre medios de cultivos sólidos.
• Se estudió las funciones de dichas enzimas durante el proceso de patogénesis, establecimiento de la infección y procesos nutricionales del hongo.
Los aportes científicos se centran en socializar procedimientos técnicos, fundamentos y elementos para la detección de enzimas en hongos fitopatégenos, evidenciándose que la detección de enzimas con técnicas de laboratorio permiten acelera el proceso y la obtención de resultados, demostrando la viabilidad que presentan estos estudios. Además este post busca llamar la atención no solo de profesionales en el área de la botánica, sino de áreas afines, incluso la de facilitar el conocimiento a través de cuadros e imágenes que permitan la captación de la información.
[1]. Agrios, G. 2005. Fitopatología. Academic Press. USA.
[2]. Bayer, E.. 2006. Cellulose-descomposing bacteria and their enzyme systems, Prokaryotes. 2:578-617
[3]. Montiel, A. 2005. Identificación de la enzima responsable de la degradación de pentaclorofenol (PCF) en Amylomyces rouxii y optimización del mecanismo de degradación mediante la expresión heteróloga de peroxidasas. Tesis doctoral. Universidad Autónoma Metropolitana, Iztapalapa, D.F. Mexico.
[4]. Bailon, L., R, Gonzalez y A, Cervantes. 2003. Atlas De Pruebas Bioquímicas Para Identificar Bacterias. Universidad Autónoma de México.
[5]. Levin L. y Forchiassin, F. 2006. Aplicaciones biotecnológicas de los hongos lignocelulolíticos. Difusión a través de FABA Informa.
[6]. Infante. D., B. Martínez., N. González., y. Reyes. 2009. Mecanismos de acción de Trichoderma frente a hongos fitopatógenos. Rev. Protección Veg. Vol. 24 No. 1 (2009): 14-21.
[7]. Ríos, J. 2009. Notas del curso de bacteriología y virología. Universidad Autonoma De Sinaloa Escuela Superior De Agricultura Del Valle Del Fuerte. 84p.
[8]. Ortiz. M, L. Martha, D. Uribe. V. 2010. Determinación De La Actividad Lignocelulolítica En Sustrato Natural De Aislamientos Fúngicos Obtenidos De Sabana De Pastoreo Y De Bosque Secundario De Sabana Inundable Tropical. Cienc. suelo vol.28 no.2 Ciudad Autónoma de Buenos Aires ago./dic. 2010
[9]. Taylor, T. 1974. Biochemical tests for identification of mycelial cultures of basidiomicetes. Annals of Aplied Biology. 78:113-123.
[10]. Stalpers, J. 1978. Identification of Wood-inhabiting Aphyllophorales in pure cultura. Studies in Mycology. 16:1-248.
[11]. Valenzuela, E., S. Leiva y R. Godoy. 2001. Variación estacional y potencial enzimático de microhongos asociados con la descomposición de hojarasca de Nothofagus pumilio. Revista Chilena de historia natural. 74:737-749.
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @curie.
If you appreciate the work we are doing then consider voting both projects for witness by selecting stem.witness and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Gracias por el apoyo
✅ Enjoy the vote! For more amazing content, please follow @themadcurator for a chance to receive more free votes!
Gracias por el apoyo
Congratulations @maribelf! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board
If you no longer want to receive notifications, reply to this comment with the word
STOPTo support your work, I also upvoted your post!
Lo hiciste muy bien, jeje como le decimos a nuestros niños.
Gracias @xeliram
Hola @maribelf, tu aporte es excelente, muy educativo, específico y de fácil entendimiento para la comunidad en general, si bien muchos no somos expertos en tu área, es claro que el proceso de aparición de esos hongos en los alimentos lo hemos detectado y ciertamente desconocemos el interesante proceso que se están gestando, aunque es claro que cuando observamos esos efectos, la tendencia es a desechar esos productos por tener una aparencia que no invita necesariamente a su consumo. Creo que alguna vez cuando estuve en bachillerato realicé una experiencia similar donde se nos solicitaba a la luz de una teoría observar los procesos de descomposición que se observaban. Tu área científica de trabajo es bien interesante, creo que voy a aprender mucho de tus aportes, saludos cordiales!!
Saludos @reinaseq, esa es la idea, que aquellos que no son del área también logren comprender el contenido de mis post
Saludos! Buena publicación... Los medios de cultivos permiten tener información valiosa cuando buscamos conocer sobre una especie en particular. De seguro posteriormente nos das un vistazo microscópico de cada especie.. Nos seguimos leyendo!
Gracias profe. @alexaivytorres
Excelente publicación en la técnica de la detención enzimática en estos hongos fitopatógenos, saludos @maribelf
Gracias @felixrodriguez