Los intermareales rocosos son un ecosistema excelente para enseñar sobre diferentes patrones y procesos. En unas decenas de metros podemos ver cambios en los organismos dependiendo de muchos factores ambientales e interacciones biológicas.

Imagen tomada por Emy Miyazawa.
Los litorales rocosos son sistemas ecológicos que presentan una gran heterogeneidad ambiental y donde se establecen variados ensamblajes comunitarios de organismos (Menconi et al., 1999). Diversas observaciones a nivel global han permitido establecer que en este tipo de litoral las especies poseen una distribución no uniforme, la cual se puede caracterizar por presentar zonación vertical, cambios a lo largo del plano horizontal y variaciones al nivel de pequeñas escalas dentro de los planos verticales u horizontales (Menconi et al., 1999; Connel, 1972).
Las explicaciones a los patrones de distribución de las especies en los litorales rocosos contemplan factores físicos como la acción de las olas y el grado de cobertura del agua, la salinidad, turbidez y biológicos, como la competencia y depredación (Connel, 1972). Se ha encontrado que si los efectos del ambiente son muy intensos, éstos pueden determinar directamente la distribución de las especies en el litoral rocoso, y sí son menos intensos, al parecer son las interacciones biológicas las que se imponen al modelar la distribución de los organismos (Connel, 1972). Además, las interacciones entre factores físicos y biológicos, pueden determinar que los individuos se distribuyan en forma de manchas o parches en dichos litorales (Connel, 1972).
A pesar de la importancia que poseen los litorales rocosos como laboratorios naturales donde se observan distintos patrones de distribución de especies, éstos no han sido muy estudiados en el sur del Mar Caribe. Así, para Cruz-Motta (2007) se desconocen los procesos que determinan y/o modifican la estructura y la composición de las comunidades asociadas a estos sistemas y son muy escasos los trabajos en el área. Entre los organismos que se hallan asociados a los litorales rocosos están las algas, las cuales tienen el papel de ser los productores primarios de estos ecosistemas, contribuir a la formación de detritus y ofrecer hábitats, refugio y alimento a diversos organismos (Cordero, 2016; Morón y Ardito, 2010). En las plataformas rocosas esta ficoflora ve afectada su riqueza y distribución por la interacción de los factores bióticos y abióticos señalados anteriormente. Underwood (1991) explica que desde el siglo pasado se conoce que las algas presentes en litorales rocosos presentan limitaciones en su distribución vertical a lo largo de dichos sistemas costeros, mientras que se mantienen poco conocidos los factores físicos y biológicos detrás de dichos patrones de zonación, esto debido a la carencia de diseños experimentales formulados para poner a prueba la influencia de dichos factores. Así, una revisión de la literatura sobre el tema arroja que existen trabajos sobre la determinación de patrones de zonación de organismos sésiles en litorales rocosos, incluyendo las algas, como el trabajo de Núñez et al. (1999) en el caribe colombiano. En dicho estudio encontraron una zonación vertical de la ficoflora presente, donde las algas y grupos de animales mostraron una distribución no uniforme a lo largo de las regiones intermareal alta, media y baja. Este tipo de estudios en Venezuela, donde se evalúa el patrón de distribución de la ficoflora en litorales rocosos, son escasos y muchos se centran solo en la identificación de las algas presentes más que en su distribución. Se puede mencionar el trabajo de Sant y Grado (1997) en el estado Sucre, donde se encontró una zonación vertical en las algas y otros organismos presentes sobre el litoral rocoso de Quetepe. Otro trabajo es el de Cruz-Motta (2007), quien estudió las formas de distribución de diversos organismos sésiles, incluyendo algas, entre varios litorales rocosos venezolanos a diferentes escalas espaciales. El mismo investigador indica en su trabajo que la estructura y composición de las comunidades asociadas a litorales rocosos se ven afectadas por diversos factores que actúan a distintas escalas espaciales y temporales. Así, las corrientes oceanográficas y las variaciones climáticas globales tienen influencia a grandes escalas espaciales de cientos de kilómetros, mientras que las interacciones biológicas y la microtopografía operan a la escala de centímetros (Cruz-Motta, 2007).
En el presente trabajo, conociendo que los cambios en la estructura comunitaria de algas en la Bahía de Patanemo se pueden deber a gradientes ambientales, se planteó la hipótesis de que las comunidades varían a lo largo del eje perpendicular a la costa, según el grado de exposición que tenga el litoral rocoso a la marea. Para poner a prueba dicha hipótesis, se planteó estudiar la composición de las comunidades de algas a lo largo de la región intermareal del litoral rocoso de la Bahía de Patanemo a distintas escalas espaciales. Para ello, se contrastaron dos áreas (separadas por kilómetros), zonas dentro de esas dos áreas (separadas por decenas de metros), transectas dentro de esas zonas (separadas por metros) y réplicas (separadas por centímetros). Esto como una primera aproximación al modo de distribución de estos organismos, dejando a estudios posteriores el diseño de estrategias que lleven a determinar otros factores que determinan tal distribución.
MATERIALES Y MÉTODOS
A. Descripción de la zona de estudio
Las zonas de estudio corresponden a dos segmentos de plataforma costera, cada una de setenta y dos metros de largo (72 m), localizadas dentro de la Bahía de Patanemo (Coordenadas UTM, Zona 19P 617829.26 E, 1155750.99 N), dispuestas de tal forma que una fuera la imagen especular de la otra (Figura 1), una fue ubicada en el sentido este, la otra en el sentido oeste, y separadas por una distancia de un kilómetro (1 Km.), aproximadamente.
La Bahía de Patanemo forma parte del Parque Nacional San Esteban, declarado Parque Nacional en 1.987, con una superficie aproximada de cuarenta y tres mil quinientas hectáreas (43.500 Ha) (ParksWatch, 2004).

Imagen tomada por Zlatka Rebolledo. Parque Nacional San Esteban.
En vista de la diversidad de ecosistemas con diferentes grados de sensibilidad, la superficie del Parque ha sido compartimentado en zonas especiales, las cuales varían en las actividades antrópicas que pueden desarrollarse dentro de ellas; en este sentido, el sector Patanemo está dentro de una Zona de Servicio, destinada al suministro de servicios (por ejemplo, hotelería y entretenimiento) a los lugareños y turistas (ParksWatch, 2004). El sector de Patanemo está dentro de un intervalo de altura desde los cero a cincuenta metros sobre el nivel del mar (0 – 50 m.s.n.m.), y temperatura promedio diaria máxima de veintiocho grados centígrados (28 ºC), las precipitaciones anuales, en las zonas bajas del Parque Nacional San Esteban, rondan alrededor de los setecientos milímetros (700 mm) (ParksWatch, 2004; Sistema Venezolano de Información de Diversidad Biológica, 2018).
La plataforma oeste colinda con comunidades de manglares, seguramente, alimentadas también por las aguas de la Laguna de la Bocaina, a pocos kilómetros de la Bahía de Patanemo; en cambio, la plataforma este es adyacente a matorrales de poca altura. Por otro lado, la presencia de erizos marinos fue apreciable en ambas plataformas, pero la abundancia de éstos fue mayor en la plataforma este, la cuál era más estrecha, de mayor erosión (roca limpia) y con zonas intermareales menos marcadas en profundidad en comparación con las observadas en la plataforma oeste.
) | ) |
|---|
Figura 1.a. Zona de Estudio: (a) El sector Patanemo colinda con los pueblos de Borburata (coordenadas UTM, Zona 19P 613530.53 E, 1154679.79 N) y Gañango (coordenadas UTM, Zona 19P 614088.96 E, 1157182.42 N). En (b) es representada la Bahía de Patanemo (coordenadas UTM, Zona 19P, 617829.26 E, 1155750.99 N), donde quedan reflejadas las zonas de estudio; las plataformas costeras bajo estudio (coloración amarilla) son imágenes especulares la una de la otra, cada una tiene una longitud de 72 m, y están separadas por una distancia próxima de 1 Km. (Google Earth, 2018).
B. Descripción de la metodología de campo.
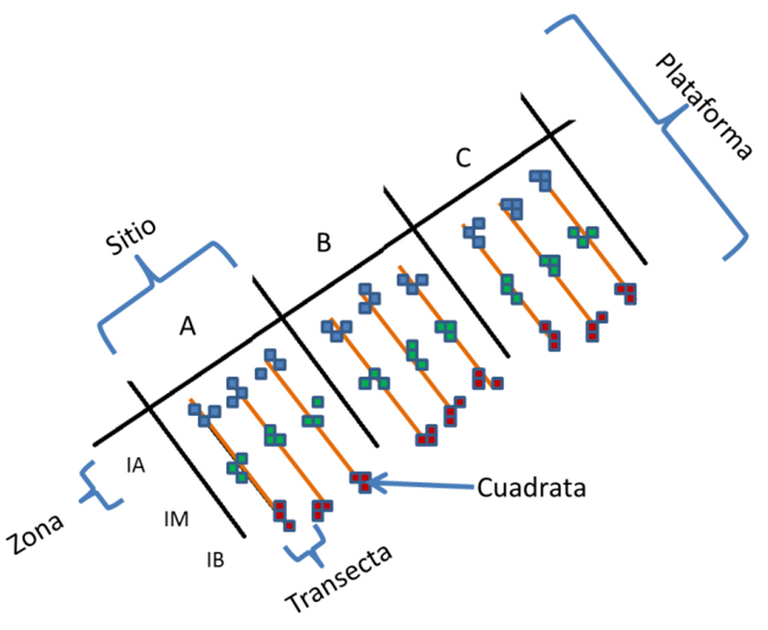
Figura 1.b. Zona de Estudio: Metodología del muestreo en campo. (Elaborado por Zlatka Rebolledo, 2018)
Sobre dos plataformas rocosas de la Bahía de Patanemo (Este y Oeste), se seleccionaron 3 zonas dentro de cada plataforma (A, B y C), se trazaron 3 transectas separadas 5 m entre sí para cada zona, y en cada transecta se colocaron 9 cuadratas de 1 m2, cubriendo así cada región intermareal: intermareal alta (IA), intermareal media (IM) e intermareal baja (IB).
En el trabajo de campo se estimó la cobertura de las algas, en cada cuadrata se contó la superficie que cubre cada especie de alga, en cada cuadrata. A partir de los datos obtenidos se construyó una matriz de “m” especies o variables respuesta (columnas) por “p” muestras (cuadrantes).
Posteriormente en el laboratorio se realizó la identificación taxonómica de las algas colectadas, utilizando las guías de identificación de algas.
C. Descripción de la metodología estadística. Análisis de datos.
El diseño experimental tomó en consideración la variable independiente cobertura (m2) en cuatro sitios, zona intermareal (Zo), transepto (Tr), sitio (Se), y plataforma (Pl). Se consideró que la variable cobertura en la plataforma, sitio y transepto puede tener una variación en sentido vertical desde la orilla hacia el mar, en cambio, la variable cobertura evaluada en cada zona tiene un sentido horizontal, es decir, a lo largo de la plataforma; este modelo permite construir, por lo tanto, siete fuentes de variabilidad: a. Zo, b. Pl, c. Se(Pl), d. ZoxPl, e. Tr(Se(Pl)), f. ZoxSe(Pl) y g. Zox(Tr(Se(Pl)).
Para evaluar las fuentes de variabilidad, e identificar la variable independiente que mayor contribuye en la estructura de las comunidades de algas, se realizó una prueba PERMANOVA sobre la matriz resultante del estudio.
Se elaboró una matriz de similaridad entre muestras para profundizar las conclusiones diagnosticadas por la prueba PERMANOVA, es decir, identificar las muestras que causan las diferencias significativas reconocidas, y procurar reconocer qué especies predominan en tales muestras. Para la construcción de la matriz de similaridad, fue empleado el índice de Bray – Curtis, el cual asume que las muestras son obtenidas desde un mismo espacio físico y permite hacer comparaciones entre muestras con cantidades pequeñas y grandes de individuos por igual (Buttigieg y Ramette, 2014; Greenacre, 2008). Obtenida la matriz de similaridad, y con el propósito, entonces, de resumir los resultados de la misma, fueron realizados dos tipos de diagramas: uno de escalamiento multidimensional métrico (ordenación) y otro de clasificación jerárquico (dendrograma); para comprobar la fidelidad de los diagramas, fue evaluado el parámetro “STRESS” y realizado una prueba “SIMPROF” para los diagramas de ordenación y clasificación jerárquico, respectivamente. Además se realizó una prueba “SIMPER”.
Para la construcción de la matriz de estudio se utilizó Microsoft Excel 2011, para la generación de la matriz de similaridad, la prueba PERMANOVA y para el montaje de los diagramas se empleó el software PRIMER V. 7.

Fuente: Primer-E
CONSIDERACIONES SOBRE LA METODOLOGÍA
Variable respuesta: Estructura de las comunidades de algas entre las estratificaciones horizontales (zonas) y/o verticales (plataforma, sección y transepto).
¿Por qué usamos el índice de Bray-Curtis? Con el propósito de obtener una matriz de similaridad entre muestras, fue empleado el índice de Bray – Curtis, el cual asume que las muestras son obtenidas desde un mismo espacio físico y permite hacer comparaciones entre muestras con cantidades pequeñas y grandes de individuos por igual (Buttigieg y Ramette, 2014; Greenacre, 2008).
¿Qué se hizo con la matriz de similaridad? Con el propósito de resumir los resultados de la matriz de similaridad, fueron realizados dos tipos de diagramas: uno de escalamiento multidimensional métrico (ordenación) y otro de clasificación jerárquico. Los montajes e interpretaciones de los diagramas anteriores fueron emprendidos para identificar las muestras y/o grupo(s) de ellas responsables de las diferencias significativas de la variable respuesta diagnosticadas por la prueba PERMANOVA.
¿Por qué el empleo de PERMANOVA? El diseño experimental fue planteado para que arrojara siete fuentes de variabilidad: Zo, Pl, ZoxPl, Se(Pl), Tr(Se(Pl)), ZoxSe(Pl) y ZoxTr(Se(Pl)), donde zona (Zo), plataforma (Pl), sección (Se) y transepto (Tr) son las variables independientes. Para evaluar las fuente de variabilidad, e identificar la(s) variable(s) independiente(s) que mayor contribuye a la estructura de las comunidades de algas, fue emprendido una prueba PERMANOVA sobre la matriz resultante de estudio.
Se realizó un diagrama de ordenación de espacio Bray-Curtis non metric multi dimensional scale (nMDS), en español un escalado multidimensional no métrico. La representación gráfica en 2D presentó un estrés de 0,24, el cual es lo suficientemente bajo para permite confiar en la representación.
RESULTADOS
A. Estimación de la estructura de la comunidad de algas: Análisis de patrones de distribución Similaridad nMDS.
Con el fin de conocer si la distribución de la comunidad de algas en la Bahía de Patanemo, obedece a un gradiente ambiental y sí existen diferencias entre las zonas intermareales alta y media, alta y baja y media y baja, se presenta en la Tabla 1, el porcentaje de abundancia de las especies y sustratos por zona, con su contribución y su disimilitud, en términos generales se identificó que los substratos más disimiles son Sargassum sp., Roca, Laurencia spp. y CCA (algas coralinas crustosas) y MAT (turf o algas de césped), así mismo resaltan las especies Lyngybia sp., Caulerpa spp. y Chaetomorpha spp. Al obtener estos resultados se decidió graficar el nMDS utilizando Roca, Sargassum sp., Mat, CCA y Laurencia sp., ya que estos representan la mayor contribución en cada una de las zonas (aproximadamente el 60%) y se puede observar el patrón de manera más sencilla al analizar los diagramas.
Tabla 1. Prueba SIMPER por zonas (Intermareal alta IA, media IM y baja IB). (Elaborado por Zlatka Rebolledo. Primer 7).
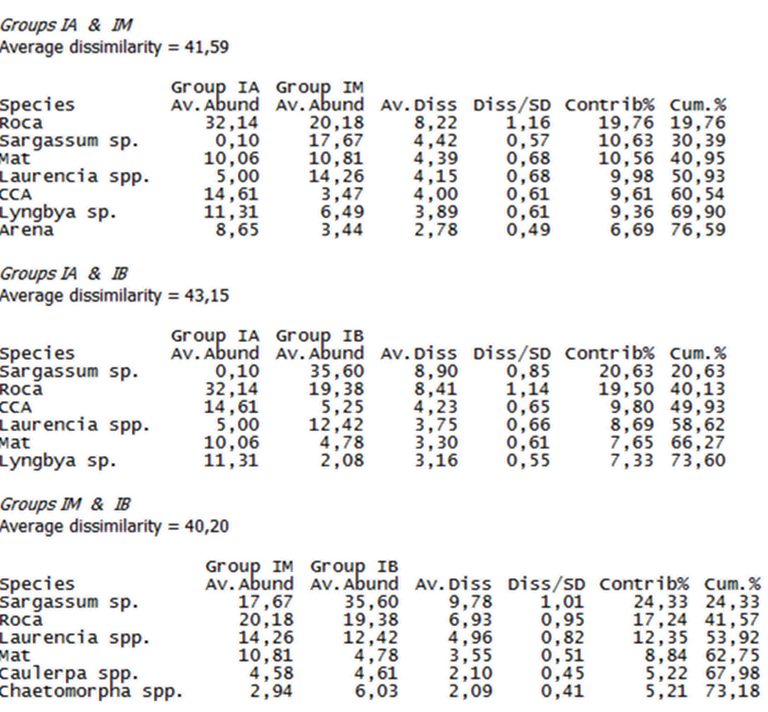
Los resultados de la prueba SIMPER concuerdan con la prueba no paramétrica de PEARSON Figura 2, la cual mide la discrepancia entre la distribución observada y la teórica (bondad de ajuste), donde se muestra que los substratos más disimiles y relevantes son Sargassum sp., Roca, Laurencia spp. y CCA (algas coralinas crustosas) y los substratos Roca y MAT (turf o algas de césped).
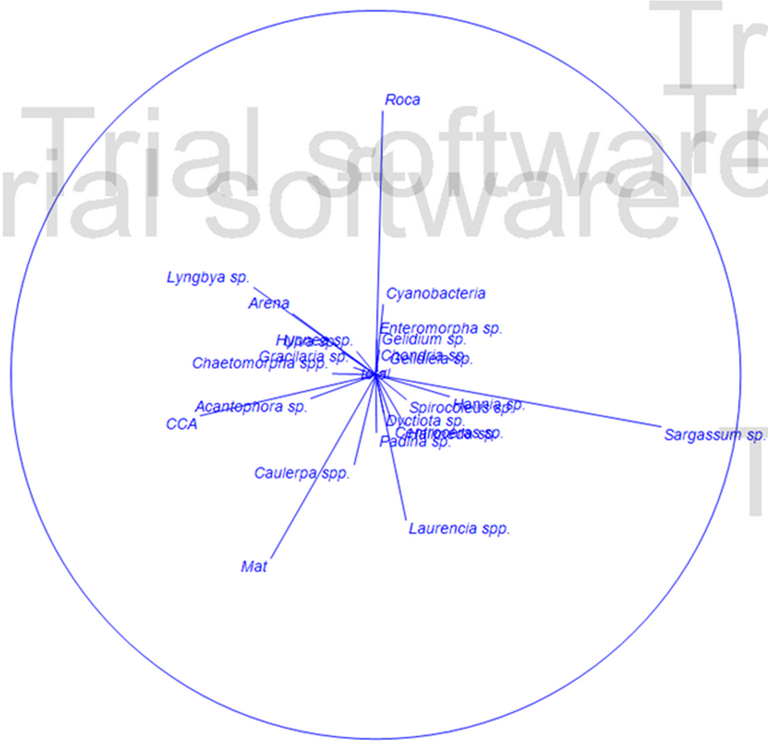
Figura 2. Clasificación de especies según análisis de componentes principales (PEARSON). (Elaborado por Zlatka Rebolledo. Primer 7).
Las Figuras 3 y 4, muestran el esquema de ordenamiento, escala multidimensional no métrica (non metric multi dimensional scale, nMDS). La representación gráfica en 2D presentó un estrés de 0,24, el cual es bastante bajo. El estrés indica la bondad de ajuste entre la matriz triangular de similaridad y el diagrama de ordenación.
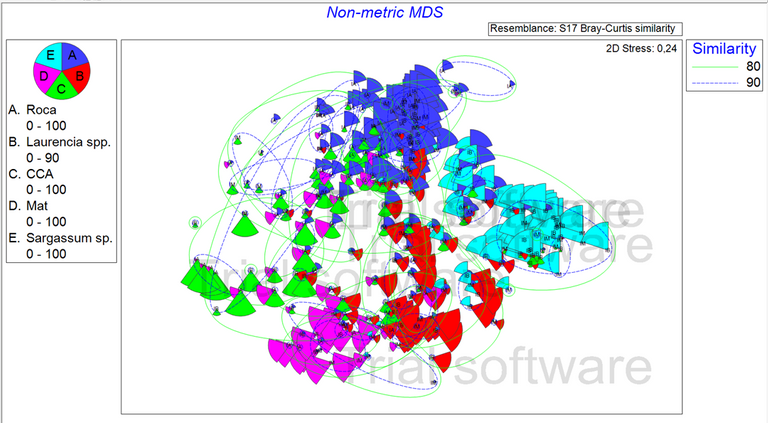
Figura 3. Diagrama de ordenación, espacio Bray Curtis, nMDS no metrico con las 5 especies más representativas. (Elaborado por Zlatka Rebolledo. Primer 7).
Las Figuras 3 y 4 muestran la abundancia por especie (tamaño de las porciones), las líneas verdes y azules que engloban las muestras representan la similaridad entre muestras según el índice de Bray Curtis. La abundancia por especie, se representa por el tamaño de las esferas y el color de la esfera indica la zona a la que pertenece.
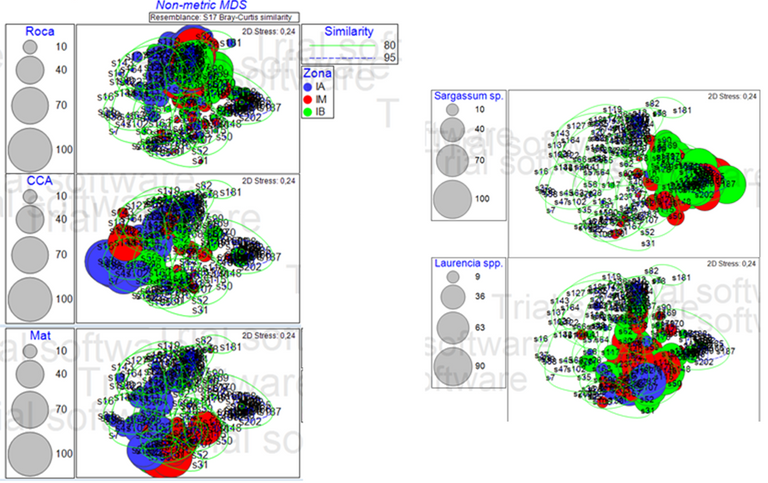
Figura 4. Diagrama de ordenación (nMDS) comparando zonas y las 5 especies más representativas (Roca, CCA, Mat, Sargassum sp. y Laurencia spp.). (Elaborado por Zlatka Rebolledo. Primer 7).
Al realizar el nMDS se pueden notar ciertos patrones, los cuales se muestran en la Figura 4, al seleccionar las especies más representativas (calculadas en la prueba SIMPER) para cada zona. Se puede apreciar un patrón de la estructura de la comunidad por zonas intermareales, debido a que dependiendo de cada zona en la marea alta, media y baja, se puede apreciar un patrón de distribución de especies distintas entre ellas.
B. Análisis de patrones de distribución de algas PERMANOVA.
Con la finalidad de establecer sí existe un patrón de distribución en las zonas intermareales, se realizó la prueba PERMANOVA.
En la Tabla 2, se muestran los resultados para los “pseudo – F” y “valores – p” para cada una de las fuentes de variación según la prueba PERMANOVA. Los resultados muestran que hay diferencia significativa entre las comunidades de algas dentro de cada plataforma, pero no entre ellas. Los resultados para la fuente de variabilidad Tr(Se(Pl)) muestran que al menos una de las transectas perteneciente a alguno de los sitios, es diferente al resto en términos de la estructura de comunidades de algas, es decir, dentro de una plataforma, podemos encontrar diferencias entre las comunidades de algas a distancias de menos de los diez metros independientemente de las zonas intermareales. También los resultados indican que independientemente de la plataforma, sitio o transecta, las zonas intermareales exhiben diferencias en términos de la estructura de las comunidades de algas.
Para cada plataforma estudiada, se puede detectar que la interacción entre los factores ortogonales verticales y horizontal (Tr(Se(Pl)).Zo) sugiere que la estructura de comunidades de algas de alguna de las zonas intermareales, de alguna de las transectas, es diferente al resto de los transeptos que están dentro de un sitio y dentro de una plataforma particular, es decir, lo anterior refleja que pueden haber diferencias significativas a escalas muy pequeñas – entre transectas y entre zonas intermareales –.
Al observar la Tabla 2, se puede señalar que no se detecta variabilidad en la distribución de las algas para Pl y Pl.Zo; sin embargo, si se detectó heterogeneidad y variabilidad para los casos de Zo, Se(Pl), Tr(Se(Pl)), Se(Pl).Zo y Tr(Se(Pl)).Zo, es posible sugerir que mientras sea menor las distancias horizontales y verticales entre las comunidades de algas, mayor será la variabilidad. Lo que podría indicar que existe una mayor variación en el plano perpendicular y no horizontal a la línea de costa.
Pseudo F Valor P | |||
1.68 0.292 | |||
3.70 0.004 | |||
2.42 0.003 | |||
1.43 0.197 | |||
5.84 0.001 | |||
2.17 0.001 | |||
2.56 0.001 |
Tabla 2. Resumen de la Prueba PERMANOVA: Existen diferencias significativa en términos de las comunidades de algas en distancias muy pequeñas, bien sea considerando sólo las transectas o la interacción entre transectas y zonas intermareales.
DISCUSIÓN
Se encontraron diferencias significativas entre las comunidades de algas dentro de cada plataforma, pero no entre ellas. Los resultados para la fuente de variabilidad Tr(Se(Pl)) muestran que al menos una de las transectas, de alguno de los sitios, es diferente al resto en términos de la estructura de comunidades de algas.
Dentro de una plataforma, se pueden observar diferencias entre las comunidades de algas a distancias menores a los diez metros, independientemente de las zonas intermareales.
Aunque no hay diferencias significativas en términos de estructura de comunidades de algas entre las zonas intermareales que pertenecen a cada plataforma (Pl.Zo); la interacción entre los factores ortogonales verticales y horizontal (Tr(Se(Pl)).Zo) indica que la estructura de comunidades de algas de alguna de las zonas intermareales, es significativamente diferente a escalas muy pequeñas – entre transectas y entre zonas intermareales –.
CONSIDERACIONES ECO-FICOFLORÍSTICAS
En este trabajo para el litoral rocoso de la bahía de Patanemo, se determinó que la mayor distribución de algas en número de especies se encontró en: roca, Laurencia spp. MAT (turf o algas de césped) y CCA (algas coralinas crustosas).
Así mismo, el género de algas más abundante fue Laurencia spp., que es un género de alga roja que generalmente vive en zona infralitoral y bien iluminada. Esta abundancia de Rhodophyta coincidió con el trabajo Guilarte y Col., 2013, en el cual hacen énfasis que “el mayor número de especies fue para el phylum Rhodophyta, las cuales estaban asociadas al sustrato rocoso. También se obtuvieron datos similares en Cuba por Jover et al. (2012), quienes estudiaron la variación espacial y temporal de las macroalgas en el mesolitoral rocoso de Aguadores-Baconao (Cuba), obteniendo una mayor diversidad de algas rojas en la superficie rocosa.
Se ha señalado además, que el patrón de distribución Rhodophyta>Chlorophyta>Heterokontophyta es típico de ambientes tropicales y subtropicales, “caracterizados por una alta riqueza y variedad de taxones, que además es común para el resto de la costa venezolana y la costa caribeña (Díaz-Piferrer 1969; Vera 2000; Solé et al. 2010)”.
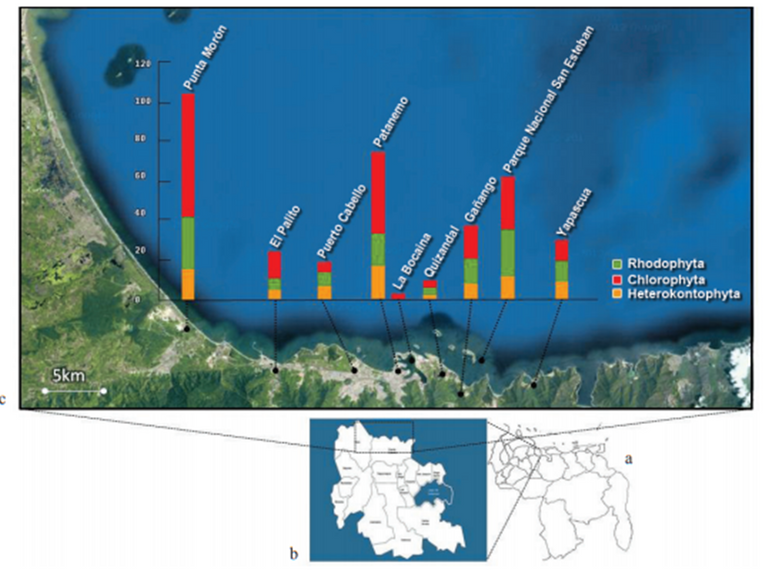
Figura 5. Situación relativa nacional del estado Carabobo. b. Estado Carabobo. c. Detalle de la costa carabobeña mostrando el número de especies por localidad entre los años 70 y 90. (Ardito S. 2013)
A partir del trabajo realizado por Ardito (2013), se identificó que en la bahía de Patanemo existieron 78 registros de algas, cuyas muestras reposan en los herbarios y gran parte de éstas datan entre los años 70 y 90, lo que indica que la bahía de Patanemo requeriría de un inventario de vegetación más actualizado.
Basado en el análisis Bray-Curtis de similaridad 80-95 se obtuvo que el MAT (turf o algas de césped) era más abundante en el sitio B, seguidos de A y C, y con mayor presencia en la zona IA, seguida de IM e IB.
En sitios con una gran cobertura de arrecifes coralinos, se ha identificado incremento en la cobertura de algas de césped, las cuales presentan más complejidad que las macroalgas (Swierts T. y Vermeij M., 2016), comparándola con otros, las algas ocupan el espacio disponible más rápidamente (Díaz-Pulido y McCook, 2002) y según Swierts, T. y Vermeij, M., (2016), el MAT en comparación con las algas y macroalgas crecen más rápido (Littler, Littler y Brooks, 2006) y son menos vulnerables al pastoreo y turbulencia del agua (Hay, 1981; Cheroske, Williams y Carpenter, 2000). Las algas del césped pueden debilitar o sobrecrecer y matar a los corales vecinos, aunque el resultado particular de una interacción competitiva depende de las especies involucradas (Jompa y McCook, 2003) y del entorno ambiental en el que tiene lugar la interacción (Vermeij et al., 2010; Barott et al., 2012)”.
Este trabajo contribuye a enriquecer el conocimiento de la distribución espacial de la ficoflora en el litoral rocoso de la bahía de Patanemo, y un hecho detectado es el cambio de la dominancia o importancia de las algas Rhodophyta sobre las Chlorophyta, al comparar los resultados de este trabajo con lo reportado para los años 70 en la zona de estudio.
CONCLUSIONES
Los resultados muestran que el patrón encontrado se adapta a la hipótesis propuesta, el cambio en la estructura de la comunidad va variando a lo largo de un gradiente ambiental. De ninguna manera podemos desechar otras explicaciones asociadas a dicho patrón, pero sí podemos asegurar que existe. Aunque no hay diferencias significativas en términos de estructura de comunidades de algas, entre las zonas intermareales que pertenecen a cada plataforma; la interacción entre los factores indica que la estructura de comunidades de alguna zona intermareal, es significativamente diferente a pocos metros de distancia. Lo cual indica que sí existe un patrón de cambios en la estructura de la comunidad asociado a un gradiente ambiental.
Para ampliar el estudio, se sugiere realizar muestreos posteriores para replicar la metodología y comparar si existe este patrón encontrado en el litoral rocoso de Patanemo en otros litorales.
REFERENCIAS
- Ardito, S. (2013). ESTADO ACTUAL DEL CONOCIMIENTO DE LA FICOFLORA MARINA DEL ESTADO CARABOBO, VENEZUELA. Currentknowledge of the marine phycoflora of Carabobo State, Venezuela Universidad de Carabobo, Facultad Experimental de Ciencias y Tecnología. Departamento de Biología. Laboratorio de Biología de Ecosistemas Marino-Costeros, Valencia-Bárbula, Carabobo, Venezuela. Págs. 215-238
- Buttigieg, PL.; y A. Ramette. (2014). A Guide to Statistical Analysis in Microbial Ecology: a community-focused, living review of multivariate data analyses. FEMS Microbiol Eco. 90: 543 – 550 – Econtrado el 23/02/2018 a las 18:00 en https://mb3is.megx.net/gustame
- Connel J (1972) Comunity interactions on marine rocky intertidal shores. Annual Review of Ecology and Systematics 3:169-192
- Cordero M (2016) Caracterización ficológica del litoral rocoso y manglares de Yapascua, Parque Nacional San Esteban, Estado Carabobo. Tesis especial de grado. Universidad de Carabobo.
- Cruz-Motta JJ (2007) Análisis espacial de las comunidades tropicales intermareales asociadas a los litorales rocosos de Venezuela. Ciencias Marinas 33(2): 133–148
- Fragoso, D. y Rodriguez, D. (2002) Algas coralinas no geniculadas (Corallinales, Rhodophyta) en el Pacífico tropical mexicano. Análisis del Instituto de Biología, Universidad Nacional Autónoma de México, Serie Botánica. Laboratorio de Ficología, Facultad de Ciencias, Universidad Nacional Autónoma de México. Apartado postal 40-720, 04510 México, D.F. Págs. 98-99
- Ganzon-Fortes, E. T., R. R. Campos & J. Udarbe. (1993). The use of Philippine seaweeds in agriculture. Appl. Phycol. Forum. Págs. 6-7
- Greenarce, M. (2008). Measures of distance between samples: non – Euclidean. Departamento de Estadística. Universidad PompeuFabra. Barcelona (España) – Encontrado el 27/02/18 a las 16:00 en http://84.89.132.1/~michael/stanford/
- Guilarte A. ,Rodriguez J., Velazques A. y Martinez E. (2013). “DISTRIBUCIÓN ESPACIAL Y TEMPORAL DE MACROALGAS BENTÓNICAS EN LA BAHÍA DE BOCA DEL RÍO, ISLA DE MARGARITA, VENEZUELA”. Universidad de Oriente, Núcleo Nueva Esparta. Venezuela. Págs. 239-259.
- Menconi M, Benedetti-Cecchi L, Cinelli F (1999) Spatial and temporal variability in the distribution of algae and invertebrates on rocky shores in the northwest Mediterranean.Journal of Experimental Marine Biology and Ecology 233:1–23
- Morón A, Ardito S (2010) Estudio ficológico del litoral rocoso de Isla Larga, Parque Nacional San Esteban, Estado Carabobo, Venezuela. Acta Bot. Venez. 33(2) http://www.scielo.org.ve/scielo.php?script=sci_arttext&pid=S0084-59062010000200002
- Núñez S, López N, García, C y Navas G (1999) Caracterización y comportamiento bimensual de la comunidad sésil asociada con el litoral rocoso de Bocachica, Isla de Tierra Bomba, Caribe colombiano. Ciencias Marinas 25(4): 629–646
- Parks Watch. (2004). Perfil de Parque – Venezuela / Parque Nacional San Esteban. Universidad Duke. Carolina del Norte (Estados Unidos). Encontrado el 23/02/2018 a las 17:00 en http://www.parkswatch.org/parkprofile.php?l=eng&country=ven&park=senp&page=phy
- Sant S. y Grado A. (1997) Zonación de un litoral rocoso en la costa sur del Golfo de Cariaco (Quetepe) Estado Sucre, Venezuela.Saber 9(1):69-76.
- Sistema Venezolano de Información sobre Diversidad Biológica. (2018). San Esteban. Ministerio del Poder Popular para el Ecosocialismo y Aguas. Venezuela – Encontrado el 27/02/18 a las 17:30 en http://diversidadbiologica.minamb.gob.ve/areas/ficha/32/
- Swierts, T. y Vermeij, M., (2016). Competitive interactions between corals and turf algae depend on coral colony form. (Consultado a través de https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4867736/#)
- Underwood A (1991) The Logic of Ecological Experiments: A Case History From Studies of the Distribution of Macro¬Algae on Rocky Intertidal Shores. Journal of the Marine Biological Association of the United Kingdom 71 (04):841- 866.
Trabajo realizado por Zlatka Rebolledo, Keysha Rodríguez, Sebastian Cestari, e Isamar Castillo. 2018.

Imagen tomada por Emy Miyazawa.
excelente trabajo Zlatka, continua produciendo información en nuestros ecosistemas marinos, esto contribuye a la creación de datos e información necesaria para la conservación de estos importantes ecosistemas, Felicitaciones para ti y tus compañeros de trabajo.
WARNINGCONFIRMED SCAM!
DO NOT FOLLOW any instruction and DO NOT CLICK on any link in the comment! - The message you received from @davidike is a
For more information, read this post:
https://steemit.com/steemit/@arcange/phishing-site-reported-postupper-dot-ml
If you find my work to protect you and the community valuable, please consider to upvote this warning or to vote for my witness.