Fisiología del equilibrio Ácido-Base

. . .
¡Espero que lo disfruten!
. . .

Introducción al equilibrio del organismo

La homeostasis involucra, una red complicada de eventos que procura mantener principalmente la concentración de electrolitos, el volumen de agua intra y extracelular, y el equilibrio de los ácidos y las bases en el plasma, de manera tal que las células estén provistas del medio ambiente idóneo para su funcionamiento.
Autor Mohamed Hassan, imagen de dominio público
Las ganancias y pérdidas de estas sustancias forman parte importante de la relación con el medio externo.
Antes de iniciar con el complejo tema del equilibrio ácido-base del organismo, debemos repasar algunos conceptos elementales para comprender los términos que van a ser utilizados en el transcurso de la publicación, como lo son:
Ácido fuerte y débil, base fuerte y débil y pH
Para simplificar podemos decir que:
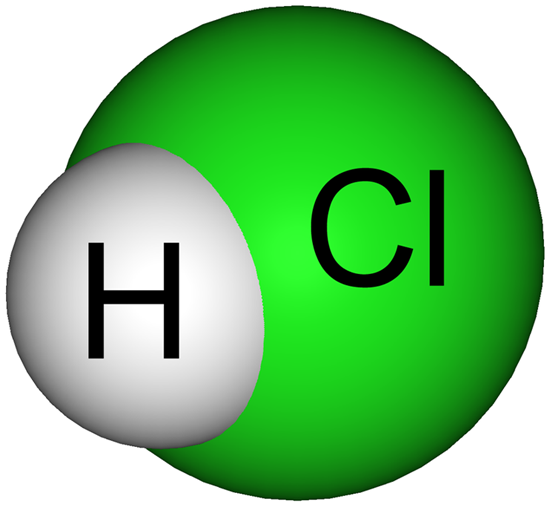
Ácido Fuerte ⟹ HCl + H2O ➡ H3O+ + Cl-
⟸ Ácido DébilCH3COOH + H2O ➡ H3O+ + CH3COO-
Autor Benjah-bmm27, imagen de dominio público
Base Fuerte ⟹ NaOH ➡ Na+ + OH -
⟸ Base DébilNH3 + H2O ➡ NH4+ + OH-
pH
Sus siglas significan Potencial de Hidrogeniones
, es una medida de acidez o basicidad de una solución mediante la indicación de la concentración de protones (H+).
Se expresa como el logaritmo negativo de base 10 en la actividad de iones de hidrógeno. Su fórmula se expresa de la siguiente manera:
pH= -log [H+] o [H+]= 10 -pH
Cuando se obtiene mediante una determinación de pH que una sustancia es ácida, quiere decir que posee una alta cantidad de iones de hidrógeno.

En contra parte, que la medición arroje que una sustancia es alcalina o básica, significa que a medida que el pH aumenta disminuye la concentración de iones de hidrógeno.


La importancia del equilibrio ácido-base
Radica en el pH óptimo que el organismo debe tener para desarrollar sus procesos de manera normal, es decir, existe un rango constante de pH que es alrededor de 7,4, un rango óptimo que va desde 7,38 a 7,42 y uno aceptable desde 7,35 a 7,45.
Este rango de pH es muy importante, puesto que ante desviaciones grandes de los valores normales se producen trastornos en el metabolismo, en la permeabilidad de la membrana y en la distribución de electrolitos.
Estás alteraciones del pH reciben un nombre que va a depender de lo enfocada o extendida que se encuentre la alteración.
Acidosis, acidemia, alcalosis y alcalemia
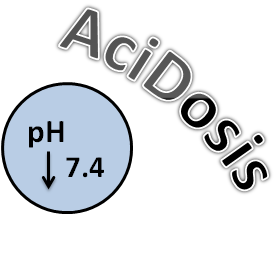
Se le llama Acidosis cuando hay un exceso de protones en los tejidos y la sangre, de manera generalizada en el organismo. Se conoce como Acidemia cuando la alteración en la concentración de hidrogeniones se encuentra localizada de momento solo a nivel del pH sanguíneo.
Imagen realizada por el autor
Imagen realizada por el autor
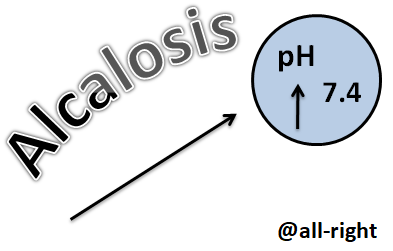
Por el contrario, la Alcalosis va a estar dada por un aumento en la basicidad de los fluidos corporales, bien sea por una disminución en la concentración de H+ o un aumento excesivo en la concentración de bases en el organismo. Y, la Alcalemia se refiere de igual manera a un aumento en la basicidad pero enfocado específicamente en el pH sanguíneo.
. . .
. . .
Aumento en la concentración de protones sobre el Sistema Nervioso
Autor Medium69/ Jmarchn, imagen CC BY-SA 4.0

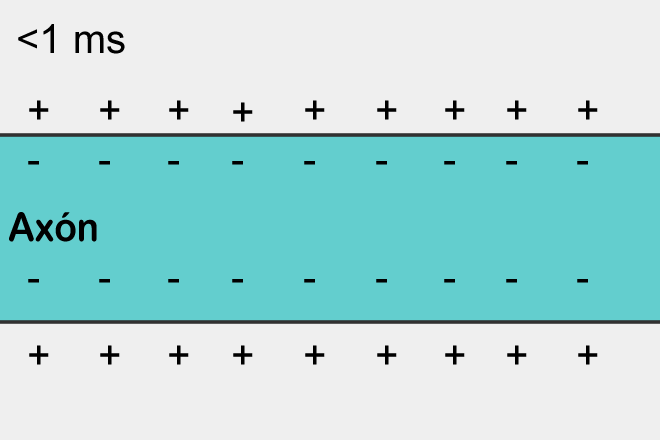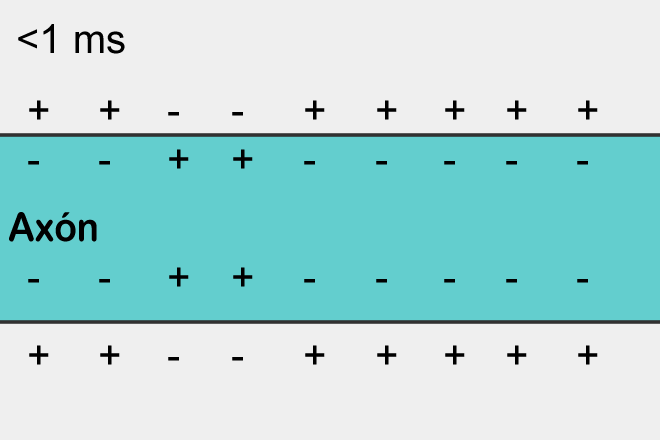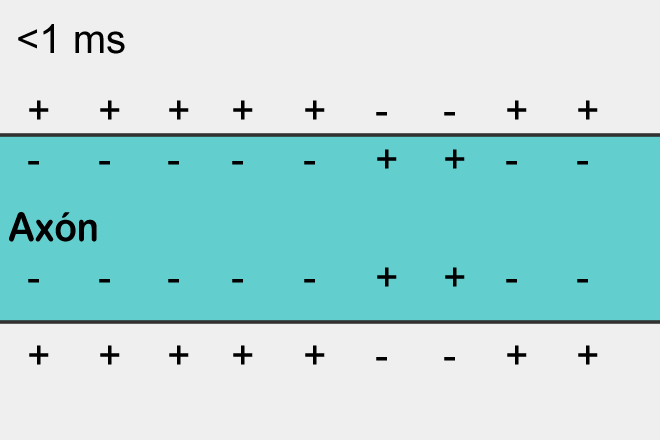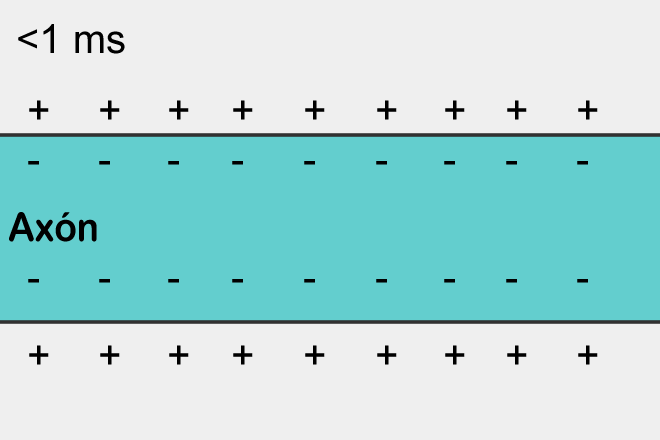
Durante una acidosis, el sistema nervioso se encuentra deprimido debido a una acumulación de protones que causan una disminución del pH. A nivel celular, se conoce que el compartimiento Intracelular tiene una carga parcialmente negativa y el Extracelular positiva, hecho que le permite reaccionar ante un potencial de acción.
Pero, durante un aumento de la concentración de hidrogeniones, la carga positiva del Extracelular será mucho mayor en comparación con el Intracelular y por ende la carga Intracelular va a ser aun más negativa y por ello el umbral de la célula será mayor, así que va a costar mucho más generar potenciales de acción que puedan ejercer un estímulo efectivo en la célula.
Disminución en la concentración de protones sobre el Sistema Nervioso
Durante una alcalosis, el sistema nervioso está sobrexcitado. La concentración de H+ en los compartimientos se encuentra disminuido y por ello el Extracelular va a tener una carga muy cercana a la del Intracelular, por lo que el umbral será muy bajo y podrá generar potenciales de acción con demasiada facilidad.
Pero por supuesto, estos estados de alteración no afectan únicamente al sistema nervioso, sino que causan grandes complicaciones alrededor de todo el organismo.
Autor Benjah-bmm27, imagen de dominio público
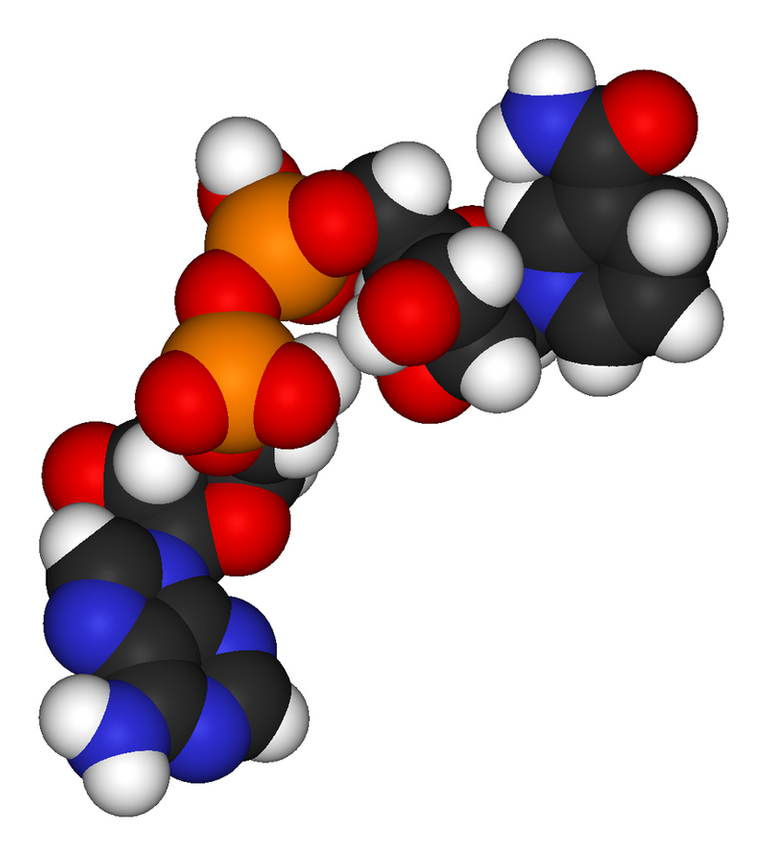
Uno de los principales problemas durante una acidosis es que se va a ver afectada fuertemente la actividad enzimática, esto debido a su misma composición estructural. Las enzimas son largas cadenas de aminoácidos que tienen la capacidad de aceptar muchos elementos de carga positiva, entonces, durante una acidosis, en donde se encuentra aumentada la concentración de protones estos se van a unir a la cadena, cambiar drásticamente su estructura y con ello, su función debido a que no pueden reaccionar con el sustrato correspondiente.
En una Alcalosis, el problema con la actividad enzimática no es tan grave, puesto que simplemente cede las pocas cargas positivas que la cadena posee sin afectar fuertemente la estructura y mucho menos la actividad.

Sistemas primarios de regulación
Los compuestos responsables de generar variaciones en el pH del organismo —tanto ácidos como bases— provienen una buena parte de la ingesta, como por ejemplo, los aminoácidos esenciales consumidos en los elementos proteicos, los ácidos grasos, entre otros. Así como también los ácidos provenientes del metabolismo celular, como lo son protones, H+. El dióxido de carbono, CO2, entre otros, siendo mayor la ganancia de H+ a través de dichos mecanismos de ingreso. Para contrarrestar los efectos que el aumento o la disminución de ácidos y bases pueda generar en el organismo, este dispone de varios mecanismos de control que funcionan a diferentes escalas de complejidad.

Los tres mayores componentes del equilibrio ácido-base en la clínica son:
- El pH, determinado por la concentración de H+
- La pCO2, regulada por la ventilación pulmonar
- La concentración de Bicarbonato en plasma, inicialmente un buffer extracelular, regulado por la función renal
Sistemas Buffer
Un buffer es una sustancia que evita que haya un cambio brusco de pH, son utilizadas para mantener el nivel de acidez o basicidad de un elemento expuesto a reacciones químicas, evitando de esa manera que se generen reacciones indeseadas.
Los amortiguadores del pH participan rápidamente en el mantenimiento del valor de pH del organismo, siendo la primera línea de defensa ante cambios de la concentración de protones (H+). Su acción es de mayor relevancia en el intracelular y en el sistema tubular renal, y por si mismos no son suficientes para mantener el equilibrio ácido-base corporal.
En estados patológicos, o cuando se generan alteraciones abruptas de pH, los sistemas buffers no son capaces de mantener un pH normal en sangre por períodos prolongados, y su acción debe ser complementada por cambios compensatorios de otros sistemas corporales. Se ve dirigido por dos sistemas:
- Sistema Amortiguador Cerrado
- Sistema Amortiguador Abierto
En el interior celular, donde se ve afectado primero el equilibrio ácido base por el metabolismo celular, los sistemas tampones más importantes son los del Sistema amortiguador cerrado, también conocido como el sistema buffer diferente al bicarbonato. Compuesto por las proteínas, especialmente la hemoglobina, y el fosfato, tanto orgánico como inorgánico.
Autor Ayacop, imagen de dominio público
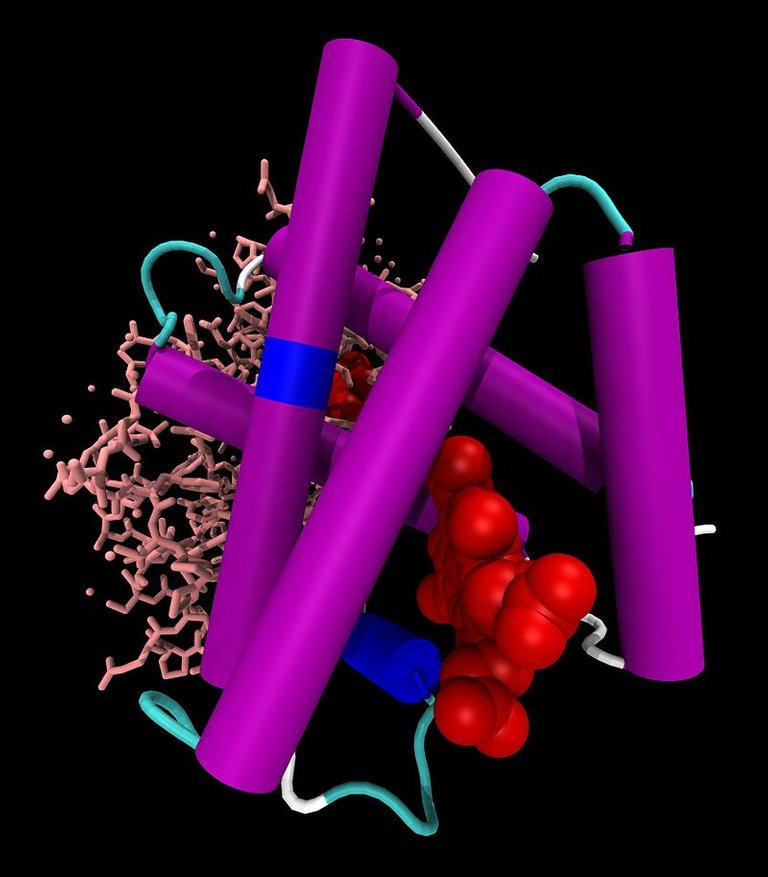
La hemoglobina oxigenada tiene menor afinidad por los iones H+ que la hemoglobina desoxigenada, lo que favorece que los protones se unan a esta proteína en los tejidos, y se liberen a nivel pulmonar, favoreciendo con ello el desplazamiento de la fórmula del ácido carbónico hacía la formación de agua y CO2, con lo cual se facilita la espiración de este gas a nivel alveolar.
En el sistema tubular renal, la acción amortiguadora más importante corre por cuenta del fosfato, el cual va a tamponar los protones secretados hacía la luz tubular para evitar la laceración del sistema tubular. El fosfato es químicamente más potente que el bicarbonato, por su mayor capacidad de aceptar H+, teniendo la capacidad de aceptar 2 H+ por cada fosfato.
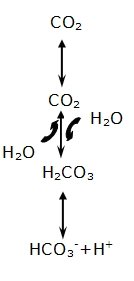
En el sistema abierto, el amortiguador más importante del extracelular es el sistema bicarbonato-ácido carbónico, debido a la mayor concentración de bicarbonato en el plasma, bien sea libre o unido a sodio, potasio o magnesio. Su importancia radica en que no sólo es capaz de amortiguar H+ uniéndose a HCO3- en presencia de anhidrasa carbónica para formar ácido carbónico, que a su vez se disociará en H2O y CO2, sino que también es capaz de modificar las concentraciones de los dos componentes amortiguadores, de forma independiente entre sí.
Esta reacción se da de la siguiente manera:
H2O + CO2 ⇄ H2CO3 ⇄ H+ + HCO3-
Está reacción, tal como lo indican las flechas, es reversible, lo que quiere decir que está continuamente sucediendo en ambos sentidos de la ecuación:
H+ + HCO3- ⇄ H2CO3 ⇄ H2O + CO2

Sistema respiratorio
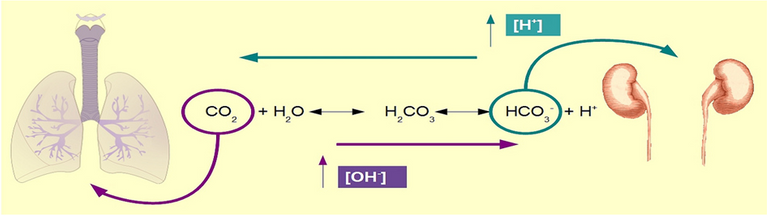
A través de la frecuencia ventilatoria (respiración externa) el organismo puede modificar la presión parcial de CO2, es decir, su concentración, y por lo tanto modificar la producción de H+ + HCO3- . Como el bicarbonato está en equilibrio con el dióxido de carbono disuelto, la medición de la presión parcial de CO2 puede usarse como estimación clínica de la concentración de ácido carbónico.
Autor Peter Forster/ v. Varenna 75/ CH-6600 Locarno, imagen CC BY 2.5
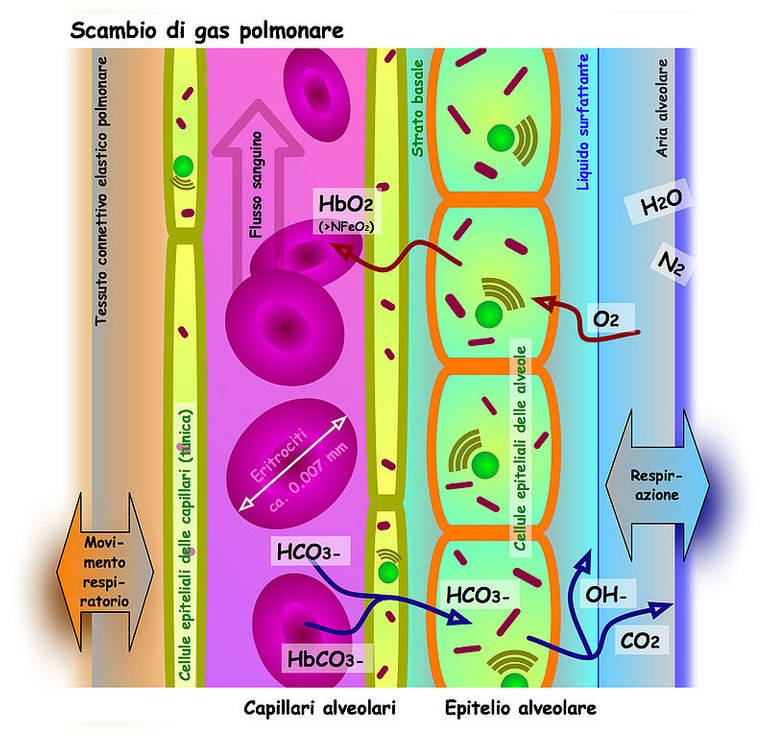
El pH no depende de los niveles absolutos de bicarbonato y CO2, sino de la relación entre ambos. Es decir, el cambio de la concentración de bicarbonato no modifica el pH si el CO2 se modifica en la misma proporción. Ahora bien, si se altera la velocidad de eliminación de CO2 se controla indirectamente el pH, puesto que el cambio en la producción metabólica de bicarbonato (renal) no responderá con la misma rapidez.
Por tanto, ante una producción exagerada de H+, que acidifican el plasma, la respuesta secundaria del organismo será generar un aumento en la frecuencia ventilatoria (hiperventilación) con el fin de eliminar grandes cantidades de CO2 y producir menos H+ . Como la tasa de producción metabólica del bicarbonato se mantuvo igual, este termina funcionando como amortiguador.
Por el contrario, ante una disminución de H+ libres, el pH sanguíneo se alcaliniza y la respuesta respiratoria será generar una hipoventilación para eliminar una menor cantidad de CO2 y favorecer la producción de ácido carbónico, cuya disociación generará un aumento en la concentración de protones y bicarbonato.
Cuando la sangre oxigenada comienza el intercambio de los capilares tisulares, el CO2 por diferencia de presión difunde hacia el plasma y hacia el interior del glóbulo rojo, allí pueden pasar dos cosas; la primera es que de manera menos frecuente el grupo carboxiterminal de la Hemoglobina recibe al CO2 y se forma un compuesto transitorio denominado Carbamino. La mayor parte del CO2 se combina con el agua del I.C para formar ácido carbónico que se disocia rápidamente en H+ y HCO3-. El H+ es tamponado por las proteínas del IC, especialmente por la Hb, mientras que el bicarbonato difunde hacia el plasma, intercambiándose por Cl-.
Cuando la sangre desoxigenada llega a los alveolos, las condiciones propias del tejido pulmonar, pH, temperatura, presiones parciales. Inducen la reversión de todos los procesos antes mencionados, es decir, el CO2 se desprende el grupo carboxiterminal difunde hacía el alveolo, mientras que el bicarbonato disuelto en el plasma difunde hacía el IC del glóbulo rojo, intercambiándose por Cloro y se combina con el protón que se ha desprendido de las proteínas intracelulares, para formar nuevamente ácido carbónico, que esta vez se disociará en H2O y CO2, este último difundirá hacia el espacio alveolar.

Sistema renal
Los objetivos de la regulación renal son mantener los niveles plasmáticos de bicarbonato y excretar el exceso de ácidos a través de la orina. Quiere decir que el riñón constantemente interviene en la regulación ácido-base a través de dos procesos:
a) La reabsorción de al menos 95% del HCO3- en el Túbulo contorneado proximal y la rama ascendente del asa de henle
Imagen realizada por el autor
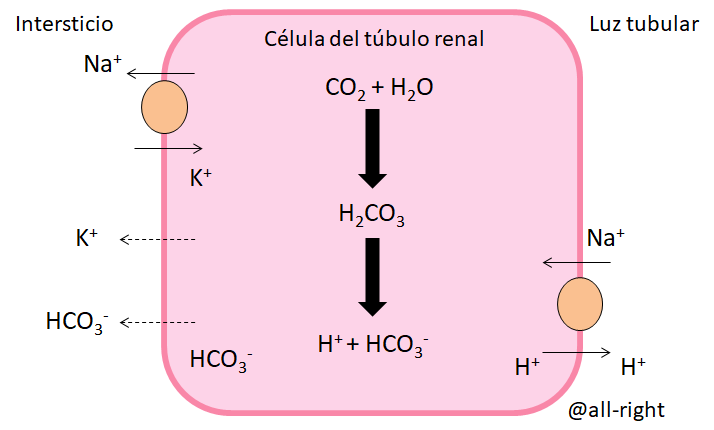
b) La excreción de ácidos, bien sea libres o combinados con la respectiva formación y adición de nuevo bicarbonato.
En el Túbulo contorneado proximal se busca reabsorber sodio hacia el intersticio y secretar H+ hacia la luz tubular. El H+ en la luz se va a unir al Bicarbonato y va a formar ácido carbónico:
H+ + HCO3- ⇄ H2CO3 ⇄ CO2 + H2O
Agua que puede ser reabsorbida o elminada con el filtrado, dependiendo de las necesidades fisiológicas. El CO2 entra a la célula en la que se va a unir al H2O y va generar la siguiente reacción:
H2O + CO2 ⇄ H2CO3 ⇄ H+ + HCO3-
El H+ se intercambia con el Na+ y el HCO3- se reabsorbe.
También en el Túbulo contorneado proximal se puede transformar glutamina, la glutamina va a formar NH3 y AlfaCetoglutarato, un subproducto de la glutamina, que se va a seguir transformando para obtener a partir de él 2 moléculas de bicarbonato.
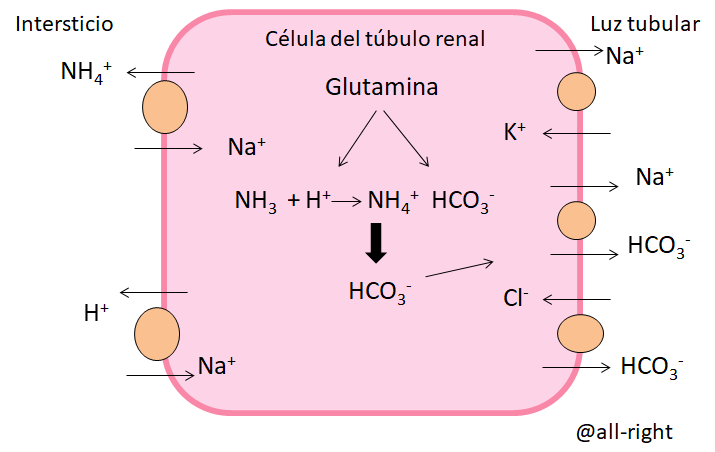
El H+ se va a unir al NH3 y va a formar NH4+ que busca ser eliminado intercambiándolo por Na+ que va hacia el Intracelular y el NH4+ en la luz tubular se puede unir al Cl- para formar cloruro de amonio. A través del ciclo de la glutamina el cuerpo forma 2 moléculas de HCO3- nuevas.
Elaborado por el autor
Células principales e intercalares
En el túbulo contorneado distal encontramos como compensadores a las células principales y las intercalares. Las principales tienen la función de reabsorber sodio y agua y secretar potasio, pero dado que no se quiere perder potasio actúan las células intercalares tipo alfa.
Elaborado por el autor
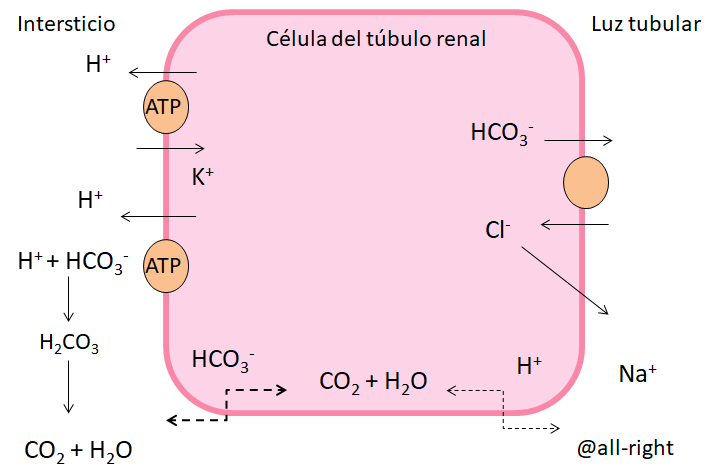
Las células intercalares tipo alfa, que se encuentran en mayor proporción y cuyo propósito es reabsorber K+ y secretar H+, este sistema se activa en casos extremos de acidosis, con el fin de eliminar el exceso de ácidos, absorber bicarbonato que a su vez va a ayudar a tamponar el exceso de protones.
Y a su vez, las células intercalares tipo beta, van a actuar en casos de extrema alcalosis secretando bicarbonato y potasio hacía la luz tubular y reabsorbiendo hidrogeniones.
Referencias
Fisiología médica Ganong 23a edición, Editorial McGraw Hill.
Tratado de fisiología médica Guyton&Hall 12da edición, Editorial Elsevier Saunders.

¡Hasta la próxima publicación! ¡Muchas gracias por leer!

Una información muy completa. Bien útil para estudiantes de ciencias de la salud. Saludos
Congratulations @all-right! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click on the badge to view your Board of Honor.
If you no longer want to receive notifications, reply to this comment with the word
STOP