Espectroscopia de infrarrojo con trasformada de Fourier (FTIR).
La energía interna de una molécula en una primera aproximación puede ser comprendida como la suma de los niveles de energía rotacional, vibracional y electrónica. La espectroscopia de infrarrojo es el estudio de las interacciones entre la materia y el campo electromagnético en la región del infrarrojo (IR). En esta región espectral, las ondas se acoplan principalmente con las vibraciones moleculares. En otras palabras, una molécula puede ser excitada a un estado vibracional más alto mediante la absorción de radiación infrarroja. La probabilidad de que una frecuencia de IR en particular sea absorbida depende de la interacción de esta frecuencia con la molécula. En general, una frecuencia será fuertemente absorbida si su fotón de energía coincide con los niveles de energía vibracional de la molécula. La espectroscopia es por tanto una técnica muy poderosa la cual nos provee de información única referente a la composición química de la muestra.
Principio fundamental.
El infrarrojo se divide en tres regiones: infrarrojo cercano, medio y lejano. De estos tres el infrarrojo medio el cual se comprende entre los 4000 cm-1 y 400 cm-1, es el utilizado en análisis cualitativo y cuantitativo de sustancias químicas. La energía asociada con esta región del IR no es suficientemente fuerte para excitar electrones, pero si lo suficiente para inducir excitación vibracional a los átomos enlazados covalentemente. Los enlaces covalentes en las moléculas no son rígidos. Por lo contrario, son más parecido a un resorte el cual puede ser estirado y doblado. Los movimiento vibratorios de una molécula son característicos de los átomos que la componen. En consecuencia, prácticamente todos los compuestos orgánicos absorberán la radiación infrarroja que corresponde en energía a estas vibraciones. Esto permite obtener espectros de absorción de compuestos que son un reflejo único de su estructura molecular.
Vibraciones moleculares.
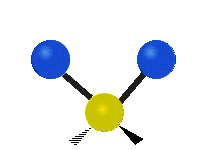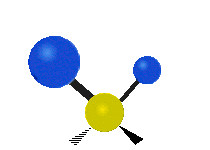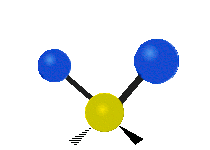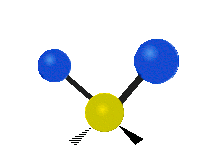
Los movimientos vibracionales que posee una molécula son los siguientes:
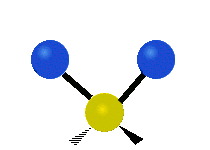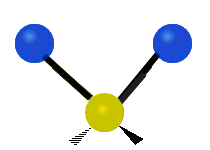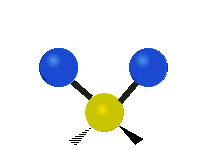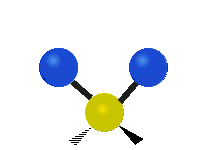
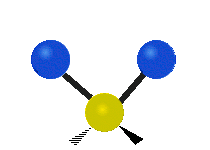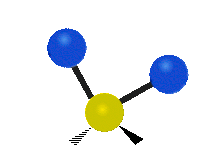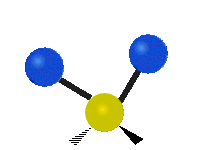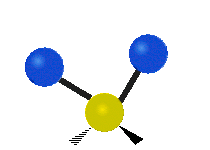
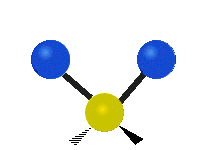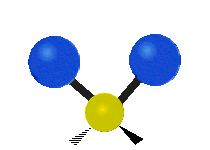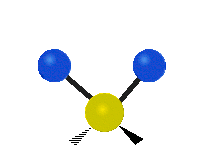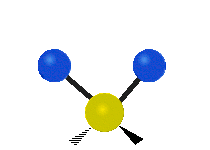
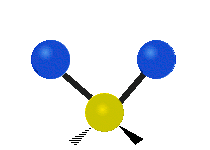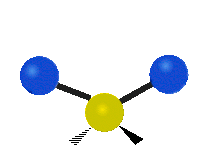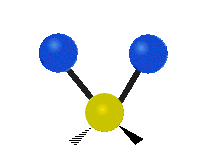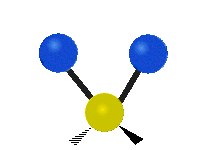
Vibración de tensión: Supone un cambio continuo en la distancia interatómica a lo largo del eje del enlace entre los átomos. Se divide en dos tensión simétrica y asimétrica (Figura 2).
Vibración de Flexión: Se caracterizan por un cambio en el ángulo entre enlaces. Se divide en Balanceo en el plano, balanceo fuera del plano, tijereteo en el plano, y torsión fuera del plano (Figura 2).
.gif) | 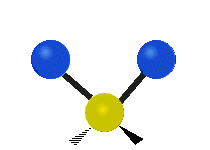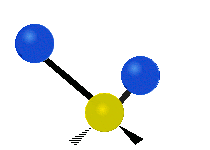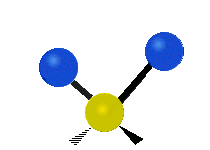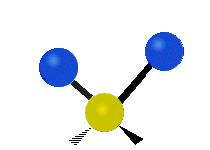 |
|---|---|
 |  |
 |  |
Las diferentes frecuencias a las que responde distintos tipos de enlaces químicos ya han sido tabuladas, esto ayuda a interpretar un espectro de infrarrojo de forma rápida e identificar gran parte de los grupos funcionales presentes. En la figura 3 se muestran las frecuencias a las que algunas vibraciones se producen.
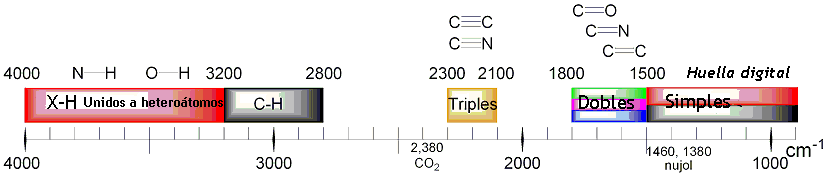 Figura 3. Grupos funcionales y frecuencia de interacción.
Figura 3. Grupos funcionales y frecuencia de interacción.Espectrofotómetro y espectro de absorción.
El espectro de infrarrojo se obtiene cuando un haz de luz infrarroja generada por la fuente del espectrofotómetro pasa a través de la muestra ubicada en el porta muestra, esta se puede encontrar en estado sólido, líquido o gaseoso. Cuando la frecuencia del infrarrojo coincide con la frecuencia vibracional del enlace o el grupo de enlaces presentes, se da el fenómeno de absorción. Por tanto, existirá una diferencia entre la energía emitida por la fuente y la recibida por el detector del espectrofotómetro. Por tanto, el análisis de la radiación infrarroja transmitida demuestra que tanta energía fue absorbida a diferentes frecuencias por la muestra. Cabe resaltar que para obtener un espectro representativo de una muestra primero se debe hacer un escaneo sin la muestra como referencia para eliminar las interferencias mismas del equipo y las ambientales como lo es el CO2 y el vapor de agua H2O presente en el aire.
Finalmente, los datos obtenidos generan un interferograma el cual representa la luz de salida en función de la posición del espejo (espejo que se mueve dentro del espectrofotómetro el cual altera la distribución de la luz infrarroja). La data del interferograma es posteriormente tratada empleando un análisis por transformada de Fourier convirtiendo la data cruda en el resultado deseado (espectro de la muestra). En la figura 4 podemos apreciar lo antes expuesto.
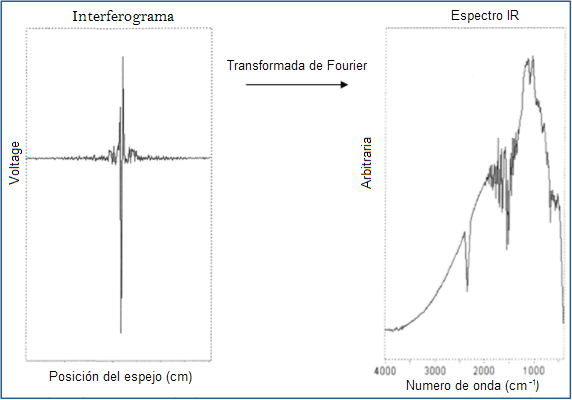
Figura 4. Interferograma y espectro FTIR.
Aplicación de la espectroscopia FTIR.
Pasando de la teoría a la práctica, en la Figura 5 les muestro un espectro de FTIR realizado personalmente a tres compuestos químicos conocidos como líquidos iónicos. Estos compuestos son empleados como precursores en la síntesis de carbondots, en un trabajo de investigación que actualmente llevo a cabo. Estos espectros fueron realizados empleando un espectrofotómetro BRUKER modelo TENSOR II con un accesorio de reflectancia total atenuada (ATR) con una resolución de 4 cm-1.
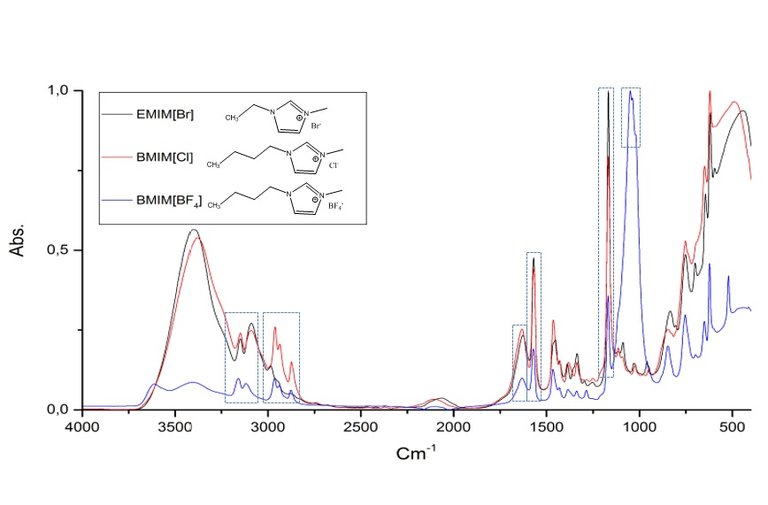 Figura 5. Espectro FTIR de los liquidos ionicos EMIM[Br], BMIM[Cl] y BMIM[BF4].
Figura 5. Espectro FTIR de los liquidos ionicos EMIM[Br], BMIM[Cl] y BMIM[BF4].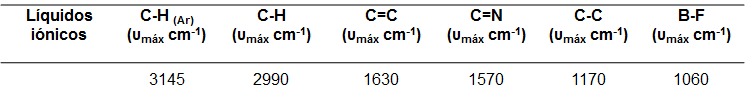
En la figura 5 podemos observar que existen ciertas similitudes espectrales, siendo las señales más destacadas las observadas en la región comprendida entre 2800 y 3000 cm-1, asignada a la tensión simétrica y asimétrica de los enlaces C─H perteneciente a las cadenas alquílicas laterales al anillo imidazol. La frecuencia e intensidad de absorción dependerán de la longitud de la cadena alquílica lateral unida al catión imidazolio. De igual forma podemos observar las señales características para la tensión simetría y asimétrica característica del enlace C─H perteneciente al anillo aromático en la región comprendida entre 3000 y 3200 cm-1 aproximadamente, en esta señal existe una contribución adicional por resonancias de fermi y sobretonos. Adicional a esto, tenemos las señales a 1630 y 1570 cm-1 aproximadamente características de los enlaces C=C y C=N respectivamente, a 1170 cm-1 aproximadamente observamos una señal que se atribuye al enlace C─C y por ultimó la señal correspondiente a la tensión B─F para el caso del BMIM[BF4] proveniente del anión [BF4]- aproximadamente a 1060 cm-1.
Lo más relevante que podemos observar al comparar los espectros es que no existe señal alguna que represente o sea característica entre el anión y el catión, lo cual se debe a que forman enlaces iónicos (atracción electroestática) y no covalentes. Por otra parte, si comparamos el espectro para el EMIM[Br] y el BMIM[Cl] podemos observar un incremento en la señal característica para la tensión del enlace C-H perteneciente a los grupos alquílicos de las cadenas laterales entre los 2800 y 3000 cm-1. El BMIM[Cl] posee un grupo butil y el EMIM[Br] un grupo etil es decir 4 y 2 carbonos respectivamente por tanto mientras mayor sea la proporción de un grupo funcional mayor será la intensidad de la señal correspondiente.
En este caso la espectroscopia de infrarrojo nos permite asegura que el material a utilizar no posee contaminantes, debido a que solo se observan las señales características de la sustancia a emplear. En otros casos donde la sustancia es desconocida esta técnica nos permite tener una idea de la posible estructura química de la sustancia debido a los grupos funcionales presentes. Sin embargo, es necesaria mas información para establecer la estructura química. Por tanto, se utilizan otras técnicas como espectroscopia de masas y resonancia magnética nuclear para recopilar información suficiente y establecer una estructura molecular exacta.
La espectroscopia de FTIR también permite observar cambios estructurales o composicionales de una sustancia durante un proceso de síntesis permitiendo asi poder establecer un mecanismo para dicha reacción. Ademas, esta técnica en conjunto con formalismos matemáticos como lo es la correlación bidimensional resulta ser de gran utilidad para enfatizar señales espectrales únicas que no pueden ser fácilmente observadas mediante un espectro convencional de infrarrojo.
Esto demuestra la gran utilidad de aprovechar la respuesta de la materia ante la radiación electromagnética, lo que nos ofrece una gran capacidad para ampliar nuestros conocimiento sobre el comportamiento de la misma.
Referencias.
- Infrared spectroscopy
- Fourier-transform infrared spectroscopy
- Infrared Spectroscopy
- Griffiths P. y Haseth J. (2007). "Fourier Transform Infrared Spectrometry". Segunda edición. New York: Wiley-Interscience.
- Ashraf A., Frederick R. y Sedman P. (1997). "Fourier transform infrared spectroscopy: Principles and applications". Elsevier Sciences. 18, 93 - 139.
Thanks.
Felicidades!
Gracias.