Introducción
Los complejos del Ni(II) con etilendiamina H2N-CH2-CH2-NH2 son todos octaédricos. El ligando también bidentado, a través de los pares no ligantes del nitrógeno no distorsiona lo suficiente el campo, por eso el desdoblamiento energético es mucho menor, y se van sustituyendo los ligandos acuo, sucesivamente por etilendiamina, por ello los cambios de color dependen del número de ligandos sustituidos; a mayor cantidad de grupos nitrógeno, mayor desdoblamiento ( desde 16000 cm-1 hasta los 19000 cm-1), y el color pasa de azul verdoso, a azulado y por fin púrpura en el caso de la sustitución completa.

Figura 1. Coloración de los acuocomplejos de Níquel según la radiación absorbida.
Las reacciones de formación de enlaces carbono-carbono catalizadas por varios metales de transición juegan un papel importante en la química orgánica. Las reacciones de acoplamiento cruzado han encontrado su camino hacia varias industrias como productos farmacéuticos, productos naturales y cristales líquidos. Por su parte los catalizadores de níquel desempeñan un papel creciente en la realización de una variedad de reacciones de acoplamiento cruzado en qué enlaces carbono-carbono se forman.
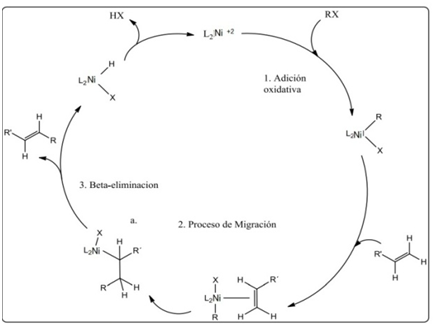
Aunque muchos estudios se centran en desarrollo de catalizadores basados en Pd, algunos de los sistemas catalíticos basados en níquel tienen también ha sido investigado. Los catalizadores de níquel tienen ventajas importantes sobre el paladio, tales como ser más barato y más respetuoso del medio ambiente. La adición oxidativa de haluros de alquilo usando paladio como catalizador a menudo es bastante lento o no ocurre, asi como también la capacidad de activar alifáticos electrófilos y para evitar la eliminación de β-hidrógeno por intermedio de alquil-metal.
f43.jpg)
Figura 2. Complejos de Níquel (II)
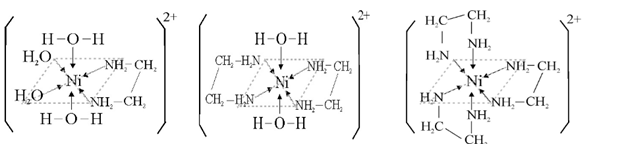
Figura 3. Complejos de Níquel con etilendiamina como ligando
Figura 4. Mecanismo de reacción de Heck. Fuente: Elaboración propia.
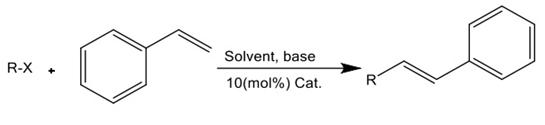
Figura 5. Reacción de Heck con bromobenceno. Fuente: Elaboración propia.
Procedimiento experimental
Síntesis de complejo de metales de transición:
Se tuvo precaución al trabajar con las sales de níquel ya que son venenosas, irritan los ojos y muchos compuestos de níquel figuran en la lista de sustancias posiblemente cancerígenas.
Para esta parte de la síntesis se trabajó bajo campana mientras se preparaba la reacción, se disolvieron 0.3g de NICl2 y 0.16 g de etilendiamina que se llevó a un balón con agitador magnético mediante esto ocurría se le fue agregando 10ml de butanol, se dejó en agitación aproximadamente unas 4 horas , se dejó enfriar a temperatura ambiente y a continuación, ya fuera de la campana , el vaso de precipitado se introdujo en una cava con hielo para lograr la cristalizacion del compuesto. Se filtran los cristales con un büchner y un kitasato conectado a una bomba de vacío por recirculación de agua y se lava en el mismo filtro con 2 mL de etanol. Los filtrados combinados se vierten al recipiente de residuos de disoluciones básicas de metales y se vuelve a conectar el büchner sobre el kitasato a la bomba de vacío durante 10 minutos para que se seque el precipitado, se transfiere a un vial cuanto estuvo totalmente seco.
Acoplamiento carbono-carbono, reacción de Heck:
Para esta parte experimental se agregaron 0.05g del catalizador NiCl2(Py2) (0.1mmol) 0.065g del polvo de zn , 1mmol 0.32g de piridina,(0.01mmol) 0.42 g (1mmol) de estireno y 0.16 g de bromobenzeno (1mmol) en el cual mediante avanzaba la reacción se le fue agregando 3ml de acetato de nitrilo, se mantuvo ajustando la temperatura para que no sobrepasara los 65ºC. Todo este procedimiento se realizó en un reactor de Bacth, este reactor tiene la ventaja de ser flexible en su uso (se le puede detener de modo fácil y rápido).
Caracterizacion por TLC y espectraoscopia IR:
Por último paso se utilizó lo que es el método de TLC ya que es muy útil para realizar el seguimiento de una reacción y la formación de productos de la misma. Es posible estudiar cómo desaparecen los reactivos y cómo aparecen los productos finales o, lo que es lo mismo, saber cuándo la reacción ha acabado. La muestra a analizar se deposita cerca de un extremo de una lámina aluminio que previamente ha sido recubierta de una fina capa de adsorbente (fase estacionaria). Entonces, la lámina se coloca en una cubeta cerrada que contiene uno o varios disolventes mezclados (eluyente o fase móvil). A medida que la mezcla de disolventes asciende por capilaridad a través del adsorbente, se produce un reparto diferencial de los productos presentes en la muestra entre el disolvente y el adsorbente. Para esta etapa se agregó a distintas laminas lo que fue el complejo inicial y el complejo final, usando como solvente el cloroformo ya que es muy estable y finalmente las placas fueron reveladas con yodo ya que no se tenía a la mano una lámpara UV. Así mismo se realizo espectroscopia IR para la caracterización del complejo metálico sintetizado obteniendo como resultado el siguiente espectro:
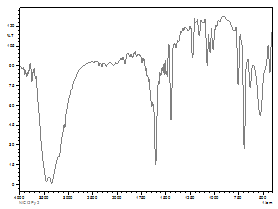
Figura 6. Espectro IR para el complejo de Níquel sintetizado. Fuente: Elaboración propia
Consideraciones finales
Una vez realizado el revelado de cada una de las placas cromatografías realizadas durante esta experiencia es necesario mencionar que no se observó la corrida del producto de reacción por lo tanto se realizó por separado una placa para cada sustrato pero aún seguíamos sin observar algún color o mancha determinada que nos indicara si hubo reacción o no, por lo tanto, fue imposible seguir la reacción a través de esta técnica de separación.
Al realizar los cálculos computacionales para nuestro complejo sintetizados se logró obtener una serie de valores asociados al mismo y además se obtuvo un espectro de infrarrojo del cual se puede extraer información de importancia asociada a nuestro complejo metálico, se aprecian las bandas características para este tipo de complejos que al ser comparadas con el espectro obtenido experimentalmente estas concuerdan con algunas diferencias presentes debido al apantallamiento producido por el cloruro presente en el complejo.
Espero que les haya gustado este post y que sea de su interés, saludos.
Referencias bibliográficas
- Fernandez W., 2014, “USO DE COMPLEJOS METAL CARBENOS N- HETEROCÍCLICOS (NHC) EN SÍNTESIS ASIMÉTRICA.” Universidad Nacional de Colombia.
- Cabrera, A., 2008, “ACTIVACION REMOTA DE COMPLEJOS DE NIQUEL, USO COMO CATALIZADORES PARA POLIMERIZACION DE OLEFINAS”, Universidad de Chile.
- Civicos, J., 2012, “Reacciones de acoplamiento carbono-carbono catalizadas por paladaciclos derivados de oximas con cloruros organicos e imidazolilsulfonatos asistida por microondas” Universidad de alicante.
- Universidad Autonoma de Madrid, facultad de ciencias, (SF), “PRACTICAS DE AMPLIACION DE QUIMICA INORGANICA”
- Zaki A., 2016, “Síntesis de catalizadores de Ni (dppe) 2 y níquel (I) y su capacidad de catalización en acoplamiento cruzado” Queen1s University.
 )
)