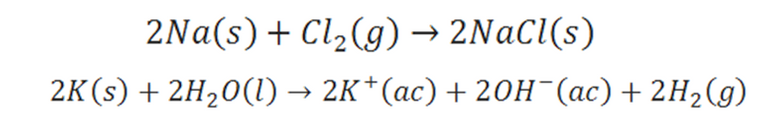Hola a todos estimada comunidad de Stem-Español, en esta ocasión quiero hablarles un poco acerca de un tema que muchas veces damos por sentado pero es de gran relevancia, se trata de cómo está organizada la tabla periódica que todos conocemos actualmente según las propiedades que caracterizan a cada elemento presente en ella. La periodicidad se describe como una propiedad de los elementos químicos, indica los elementos que pertenecen a un mismo grupo o familia de la tabla periódica tienen propiedades muy similares.
Como objetivo en este post quiero explorar un poco acerca de algunas propiedades físicas de los elementos, entre ellas el tamaño de los átomos y los iones, la configuración electrónica y la electronegatividad de los elementos. Estas propiedades se relacionan directamente con el ordenamiento de los electrones en el átomo y, por lo tanto, con la química de los elementos y sus compuestos, lo que resulta de gran importancia y de mucha utilidad a la hora de estudiar las características de algún elemento o sustancia en especial.
Asignación de los electrones
Nuestro objetivo es entender y predecir la distribución de los electrones en átomos con múltiples electrones. Cuando hablamos de la configuración electrónica del átomo de un elemento presente en la tabla periódica nos referimos a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. El principio básico que se emplea para esto es el de Aufbau o como se conoce comúnmente método de la lluvia, en el cual los electrones se asignan a las capas (definidas por el número cuántico n) de energía cada vez más alta. En una capa dada, los electrones son asignados a subcapas (definidas por el número cuántico l) de energía cada vez más alta. Los electrones son asignados de manera tal, que la energía total del átomo es la más baja posible. Ahora, lo importante es el orden de energía de las capas y subcapas.
Figura 1. Diagrama de orbitales electrónicos
Propiedades atómicas y tendencia periódicas
Una vez comprendidas las configuraciones electrónicas, los químicos que dedicaron su vida a organizar los elementos detectaron que las semejanzas en las propiedades de los elementos son resultado de las configuraciones electrónicas similares en la capa de valencia, debido a esto se enfocaron en describir cómo se relacionan las configuraciones electrónicas de los átomos con algunas propiedades físicas y químicas de los elementos, y por qué dichas propiedades cambian de manera predecible al desplazarse hacia abajo por los grupos a través de los periodos.
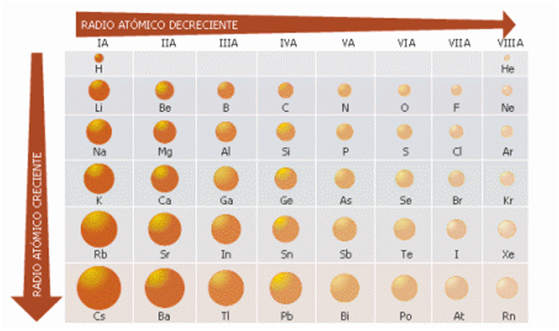
Tamaño atómico
El tamaño de un átomo es determinado por sus electrones más externos. Al ir de la parte superior a la inferior de un grupo, en la tabla periódica, los electrones más externos son asignados a orbitales que tienen valores cada vez más altos del número cuántico principal, n. Los electrones subyacentes requieren ciertos espacios, de modo que los electrones de la capa más externa deben estar más lejos del núcleo. Para los elementos de los grupos principales, los radios atómicos aumentan al descender por un grupo de la tabla periódica y disminuyen al atravesar un periodo.
Figura 2. Radios atómicos de algunos elementos
Tamaño de los iones
Los iones positivos o negativos aumentan de tamaño al descender por el grupo, sin embargo existen dos cualidades importantes que debemos resaltar:
1. Los iones positivos tienen menor radio que los átomos neutros de los que proceden: esto es debido a que cuando se forma el ión se pierden electrones, de modo que los demás electrones pueden reducir sus distancias, por lo tanto las repulsiones son menores.
2. Los iones negativos tienen mayor radio atómico que los átomos neutros de los que proceden:esto se debe a que al ganar electrones aumenta la repulsión entre los átomos.
Electronegatividad
La electronegatividad se refiere a la fuerza o a la capacidad que tiene un átomo para atraer el par de electrones que conforman un enlace químico. Esta se incrementa de izquierda a derecha a través de un período y en cada grupo en particular la electronegatividad disminuye al aumentar el número atómico y al aumentar el carácter metálico.
Tendencias periódicas
Una vez definidos algunos conceptos básicos (radios iónicos y atómicos, configuración electrónica y electronegatividad) podemos entender mucho mejor el orden de los elementos químicos. La tabla periódica como la conocemos se formó agrupando los elementos con propiedades químicas similares. Por ejemplo, los metales alcalinos forman compuestos característicos donde el metal está en forma de un ion +1, tales como, Li+, Na+ o K+. De este modo la reacción entre sodio y cloro da el compuesto iónico NaCl (formado por iones de Na+ y Cl-), y el potasio reacciona con el agua formando una solución acuosa de KOH (solución que contiene los iones hidratados K+(ac) y OH-(ac)).
Figura 3. Reacciones iónicas. Elaboración propia.
Familias elementos
Grupo I: Metales alcalinos
Los elementos que forman parte de esta familia tienen solo un electrón en su nivel último de energía. Estos tienen la particularidad de formar soluciones básicas o alcalinas al reaccionar con agua.>/div>
Grupo II: Metales alcalinotérreos
Los elementos que podemos encontrar en este grupo contienen dos electrones en el último nivel de energía.
Grupos III al XII: Metales de transición
Estos elementos son átomos con radios pequeños, a temperatura ambiente se encuentran en estado sólido a excepción del mercurio. Entre los más destacados podemos encontrar a los metales preciosos como el oro y la plata.
Grupo XIII
En sección de la tabla periódica podemos elementos de tipo metálico, no metálico y metaloides. Entre los destacados encontramos el boro y el aluminio.
Grupo XIV
En este grupo tan importante encontramos al carbono, elemento fundamental para la vida, además también forman parte de este grupo el estaño, el plomo, entre otros.
Grupo XV
Este grupo es formado por el nitrógeno, que es el gas que encontramos con mayor proporción en el aire, así como el arsénico, el fósforo, el bismuto y el antimonio.
Grupo XVI
En este grupo se encuentra el oxígeno y también el selenio, el azufre , entre otros.
Grupo XVII: Halógenos
Son no metales y poseen la facilidad de atraer electrones. Algunos de lo más importantes son el cloro y el flúor.
Grupo XVIII: Gases nobles
Son los elementos químicos más estables, sus átomos tienen repleta la última capa de electrones lo que los hace químicamente inertes. En este grupo podemos ubicar al helio y al neón, entre otros.
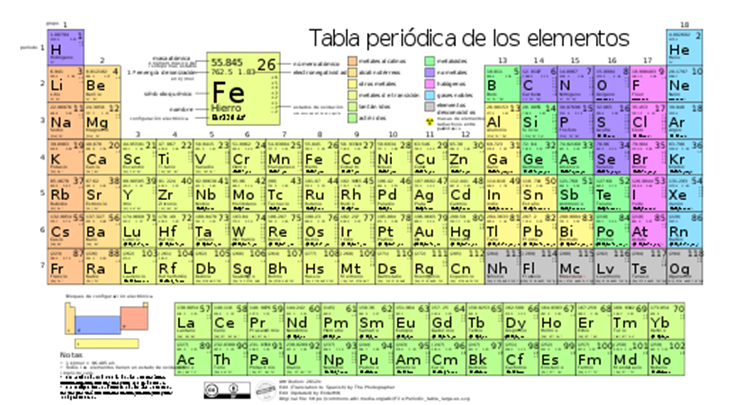
Por ultimo pero no menos importante, las dos últimas filas fuera de la tabla son correspondientes a las llamadas tierras raras, lantánidos y actínidos.
Figura 4. Tabla periódica de los elementos
Como verán la ciencia siempre tiene un orden y sigue una metodología y los lugares que cada elemento ocupa en la tabla periódica no son una excepción, cada uno se encuentra allí por una razón y aunque muchas veces demos esto por sentado cuando interiorizamos y entendemos claramente esta información es mucho más fácil entender la naturaleza de cada uno de los átomos, enlaces o sustancias que nos rodean y la química que poseen
Espero que les guste este post y que sea de mucha utilidad para ustedes, hasta una nueva oportunidad. Saludos.
Referencias
1. Chang, R. (2010). Chemistry (Vol. 10). Boston: McGraw-Hill
2.John Kotz, Treichel Paul, Quimica y reactividad química, quinta edición, 2003.