También habrás observado que el agua mineral para consumo humano especifica en su etiqueta la concentración de calcio y magnesio.
¿Sabes por qué ocurre eso?
¡En este artículo quiero presentar la respuesta a esa pregunta, te invito a revisarla!
¡Se debe al contenido de Dureza del agua!
La dureza total de las aguas es un componente con bastante significación, su determinación proporciona una medida de la calidad para su uso doméstico o industrial.
Desde hace tiempo se ha definido como la capacidad que tienen los cationes presentes en el agua para desplazar a los iones sodio o potasio de los jabones para así formar productos insolubles. Como el agua se mueve a través de suelo y roca, disuelve los minerales y los mantiene en solución. Sin embargo, en las aguas naturales la concentración de iones calcio y magnesio son superiores a cualquier ion metálico, es por ello que la Dureza ahora se define como la concentración de carbonato de calcio que equivale a la concentración total de todos los cationes multivalentes en la muestra[1]. El grado de dureza es mayor a medida que aumenta su concentración.
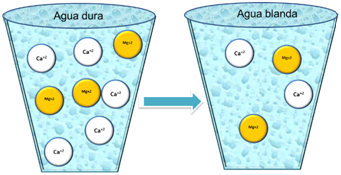
Figura 1. Tipos de agua. Fuente: propia.
¡En base a ello se pueden explicar tus observaciones!

En las tuberías se producen las incrustaciones cuando el agua dura empieza a circular ya que la cal comienza a acumularse. El calcio contenido en las aguas se cristaliza, se adhieren en las superficies produciendo inmediatamente incrustaciones calcáreas sólidas que tienen consecuencias destructivas.
Estas incrustaciones calcáreas se forman especialmente en lugares donde predominan altas temperaturas, tales como calentadores de agua, radiadores entre otros. Mientras más alta es la temperatura de la superficie, más se desarrollarán las incrustaciones de cal, esto debido a que las sales de calcio y magnesio son de solubilidad invertida, es decir, su solubilidad aumenta con la temperatura pero, al alcanzar 60 ºC o más, su solubilidad cae bruscamente causando la formación de incrustaciones y una pérdida en la eficiencia de la transferencia de calor, lo que reduce el diámetro y puede provocar la obstrucción de las tuberías[2].
Siendo el calcio y el magnesio los principales compuestos de las incrustaciones esperaríamos que los depósitos calcáreos sean de color blanco. Sin embargo, la mayor parte de estos depósitos son de color rojo. Eso explica que existe una relación entre las incrustaciones calcáreas y la corrosión. Cuando se forman los depósitos calcáreos las partículas de hierro y de hierro oxidado se fijan en ellas, esto produce el color rojizo. Lo que significa, además, que el óxido se adhiere con fuerza a los ductos causando una amenaza seria debido a la corrosión.

En relación al contenido de dureza en agua para consumo humano, ha sido ampliamente investigado y evaluado durante muchos años en diferentes estudios. Sin embargo, la Organización Mundial de la Salud indica que el agua dura no produce efecto nocivo en la salud de las personas. La dureza del agua puede influir en el sabor o en las propiedades organolépticas. En el agua potable, la dureza suele oscilar entre 10 - 500 ppm de carbonato de calcio. Para la OMS, el umbral de tolerancia habitual oscila entre 100 - 300 miligramos, aunque señala que muchos consumidores aceptan sin problemas cifras superiores (hasta 500 mg/litro)[3]. Por ello, debe especificarse en los envases su contenido de calcio y magnesio cumpliendo con los parámetros de calidad.
Existen dos tipos de dureza, la dureza temporal que viene determinada por el contenido de carbonatos y bicarbonatos de calcio y magnesio. Se puede eliminar por ebullición del agua y posterior eliminación de precipitados formados por filtración; y la dureza permanente, que viene determinada por todas las sales de calcio y magnesio excepto carbonatos y bicarbonatos. No puede ser eliminada por ebullición del agua.
Ahora bien, desde el punto de vista analítico ¿Cómo se determina la dureza en aguas?
La dureza total (dureza cálcica y dureza magnésica) se puede determinar por medio de una valoración directa basada en una reacción de complejación. La formación de un complejo implica la reacción entre un ion metálico M con un ligando L, quien debe tener disponible al menos un par de electrones no compartidos para formar el enlace.
El EDTA (ácido etilendiaminotetracético) es uno de los ligando que comúnmente se emplea como solución patrón y se pueden determinar prácticamente todos los cationes metálicos.
¡Algunos aspectos importantes del EDTA!
Es uno de los valorantescomplejométricos más versátil. Tiene seis sitios potenciales para formar un enlace con un ion metálico: los cuatro grupos carboxilos y los dos grupos amino, cada uno de estos últimos con un par de electrones no compartidos. Es un reactivo notable no sólo por formar quelatos (la palabra quelato se deriva de la palabra griega "garra". La quelación es un proceso similar a agarrar y sostener un objeto con una garra) con todos los cationes, sino también porque estos quelatosson suficientemente estables en las titulaciones. Esta gran estabilidad se debe a los distintos sitios de complejación que existen dentro de la molécula, que le confiere una estructura en forma de jaula que encierra el catión y lo aísla de las moléculas del solvente.
Por comodidad la forma ácida libre del EDTA con frecuencia se abrevia como H4Y, H3Y-, H2Y2-, HY3- y Y4-, cada una de esta especie predomina a un determinado pH.
Las cuatro constantes de disociación del ácido H4Y son las siguientes:
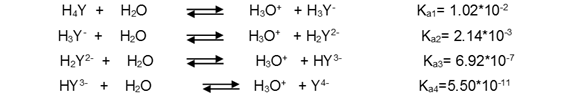
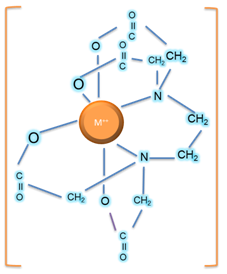
Figura 4. Estructura de un complejo EDTA-METAL. Fuente: propia.
¡Otro ejemplo importante del uso del EDTA en otros campos! Quelatos de micronutrientes con EDTA
Los quelatos son especialmente eficaces para su uso con micronutrientes que se aplican en suelos alcalinos. Esto se debe a que el hierro, el manganeso, el zinc y el cobre reaccionan con los iones que se encuentran a altos niveles de pH para formar sustancias insolubles, de esta manera los nutrientes no están disponibles para las plantas. Es así como el EDTA rodea la molécula metálica catiónica y forma enlaces débiles con ella, dando al nutriente un recubrimiento sintético neutro, evitando que las reacciones ocurran en el suelo u otros medios de crecimiento.
Las raíces de las plantas son capaces de absorber el nutriente quelado permitiendo que el quelato libere el nutriente dentro de la planta. Los agentes quelantes se usan comúnmente en los fertilizantes comerciales que permiten neutralizar eficazmente las cargas eléctricas opuestas presentes entre los micronutrientes y la zona de la raíz, lo que permite que el elemento pase fácilmente a través de la membrana celular de la raíz semipermeable y se traslade a la planta. Cuando la planta requiere el elemento quelado, eliminará el elemento cargado positivamente, como el hierro, del quelato y absorberá el elemento. Sin embargo, dado que el agente quelante es extraño para ella, rechazará el agente quelante, regresará de nuevo en la solución de nutrientes, donde una vez más es libre de quelar otros elementos.
Valoración complejométrica con EDTA para la determinación de dureza en agua
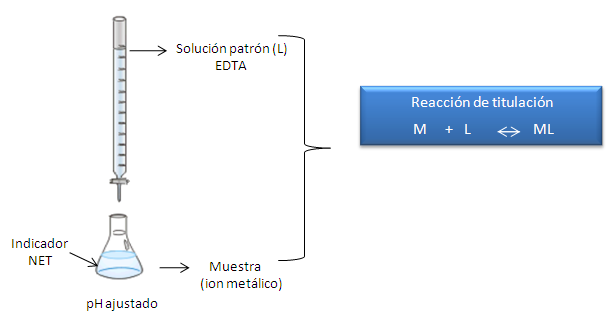
Figura 5. Valoración complejométrica. Fuente: imagen editada por el autor.
¿Qué indicador se puede emplear en las titulaciones con EDTA y cómo funcionan?
Existen cerca de 200 compuestos que pueden actuar como indicadores en las titulaciones de iones metálicos con EDTA. La mayoría de estos compuestos son colorantes orgánicos que reciben el nombre de indicadores metalcromáticos que forman complejos estables con los iones metálicos. Para que funcione como indicador en una valoración con EDTA el complejo metal-indicador debe tener un color distinto del propio indicador libre. Además la constante de formación del complejo metal-indicador debe ser menos favorable que la del complejo metal-EDTA para que se libere el indicador en el punto de equivalencia[4].
¡Un ejemplo!
El negro de eriocromo T (NET) es un típico indicador de iones metálicos que se emplea en la determinación de dureza total. Se comporta como un ácido débil.
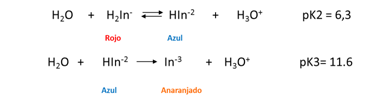
¿Cómo funciona?
Como se observa, las constantes de disociación del ácido son pequeñas, por lo que es de esperarse que la solución, la forma predominante del indicador es su forma no disociada de color rojo violáceo H2In-. Sin embargo, los complejos metálicos del NET frecuentemente también son rojos, por lo que coincide con el color del indicador lo cual dificulta detectar un cambio de color perceptible en el punto final de la valoración. Es por ello, que debe lograrse un desplazamiento del equilibrio hacia los productos en la primera disociación del indicador, predominando entonces la especie HIn2- de color azul. El desplazamiento del equilibrio se logra ajustando el pH entre 8 y 10 con una solución buffer. Generalmente se ajusta a 10 adicionando una solución de amoníaco-cloruro de amonio. Hasta el punto de equivalencia el indicador forma complejos con el ion metálico en exceso, así que la solución es roja. Con un ligero exceso de EDTA la solución se vuelve azul porque se libera el indicador.
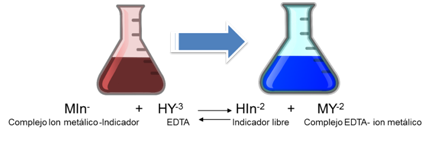
Las soluciones de NET tienen la desventaja de que se descomponen lentamente con el paso del tiempo. Se ha sugerido el uso de las soluciones de Calmagita en su lugar ya que sus propiedades son para fines prácticos similares a las del NET y sus soluciones son estables.
La dureza cálcica viene dada por la cantidad de iones Ca+2 presentes en la muestra de agua. Para su determinación se debe ajusta el pH entre 12 y 13 de modo que el magnesio precipite como Mg(OH)2 y no intervenga en la reacción. En este caso el indicador usado es el purpurato de amonio o murexida. Al comienzo de la valoración el EDTA forma un complejo con el calcio que estaba en la solución. Los complejos que forma con los metales son coloreados, siendo rojos con el calcio y amarillos para los metales cobalto, níquel y cobre. En el punto de equivalencia vuelve a su color original (púrpura) indicando el punto final de la valoración.
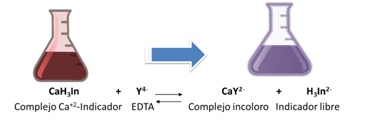
Así una vez que se determine la dureza total y dureza cálcica se puede calcular entonces la dureza magnésica.
Dureza magnésica= Dureza total – Dureza cálcica
¿Qué nos indica el resultado del análisis?
Una vez que se analiza el agua se puede clasificar según el contenido de CaCO3 presente:
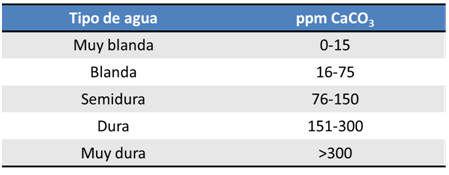
Cabe destacar que el agua se puede tratar por métodos de ablandamiento para reducir la concentración de las sales, información que les estaré presentando más adelantecon más detalles.
Ahora vemos, porque es muy importante conocer la dureza del agua que tenemos en nuestro hogar o lugar de trabajo para prevenir problemas y lograr los resultados que queremos.
Espero sea de gran utilidad la información presentada, hasta una próxima oportunidad
Referencias Bibliográficas
[1]. Skoog W., Holler C. Química analítica. 7ma edición
[2]. El problema de las incrustaciones de cal y el óxido. Disponible en:
[3]. Dureza del agua. Disponible en:
[4]. Harvey, D. (2002). Química Analítica Moderna.
https://www.cwt-international.com/cwt/es/hard-water-problems.html
https://www.fundacionaquae.org/wiki-aquae/datos-del-agua/dureza-del-agua/
Fuente de las imagenes: Titulación, Erlenmeyer
El estudio físico-químico del agua que ingerimos es de vital importancia como el líquido mismo. Es bueno contar con profesionales en el área de la Química que pueda aportar conocimientos a la comunidad #stem-espanol
Muchas gracias por leer y comentar el artículo!Ciertamente @iamphysical, el agua es esencial para la vida. Por esta razón debemos tener conocimiento de la relación entre su calidad y la salud. Así como también de la importancia de su buen uso, tratamiento y de sus propiedades para los distintos fines que se destine.
Congratulations @yusvelasquez! You have completed some achievement on Steemit and have been rewarded with new badge(s) :
Click on any badge to view your own Board of Honor on SteemitBoard.
To support your work, I also upvoted your post!
For more information about SteemitBoard, click here
If you no longer want to receive notifications, reply to this comment with the word
STOPHola @yusvelasquez. Completo artículo sobre el tratamiento del agua para determinar su dureza por los propiedades minerales. Estaré pendiente de la continuidad de tu trabajo en la aplicación de métodos conexos...
Saludos
Estaré pendiente de tus comentarios, saludos y éxitos!Muchas gracias @ulisesfl14! El análisis químico nos permite determinar la composición de variedad de sustancias y resulta importante conocer la metodología empleada y sus fundamentos teóricos.
Buen artículo @yusvelasquez, muy completa la información. Conocer la calidad del agua que usamos es muy importante, y la dureza es uno de los factores que más influye para su uso doméstico, muy interesante los otros usos del EDTA. Saludos!
Gracias @emiliomoron. Si, influye mucho en el rendimiento de equipos de limpieza así como de los detergentes, lo que se se tradce en un mayor gasto por consumo en exceso de energía y jabón. Saludos!